Відзначимо основні положення цієї теорії.
1. Адсорбція мономолекулярна.
2. При адсорбції встановлюється динамічна рівновага, яке можна розглядати як квазіхіміческіх. В умовах рівноваги швидкості процесів адсорбції і десорбції рівні.
Константа адсорбційної рівноваги
де кадс- константа швидкості адсорбції; кдес- константа швидкості десорбції.
Виходячи з даної теорії було виведено рівняння, яке ми наводимо без виведення:
де - максимальна адсорбція ПАР; Г - адсорбція при концентрації с; К - константа адсорбційної рівноваги.
Залежність величини адсорбції від концентрації представлена на рис.3.7.
На кривій чітко видно три ділянки:
I ділянку - пряма лінія, що виходить з початку координат. Дійсно, з рівняння Ленгмюра (3.15) при малих концентраціях Кс <<1,1 + Кс 1 и .
III ділянку - відповідає прямій, паралельної осі абсцис, що означає, що адсорбція досягла свого граничного значення. При цьому Кс >> 1 і 1 + Кс Кс. отже,
II ділянку - відповідає криволінійної частини графіка і описується повним eравненіем Ленгмюра (3.15).
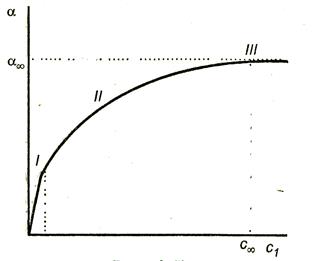
Рис.3.7. Залежність адсорбції від концентрації ПАР.
Щоб знайти постійні в рівнянні Ленгмюра, його слід привести до лінійної формі. Для цього праву і ліву частини рівняння треба «перевернути»:
Помножимо обидві частини рівняння (3.16) на з:
На рис. 3.8. показаний графік.
Тангенс кута нахилу прямої до осі абсцис
Відрізок, що відсікається прямою на осі ординат,
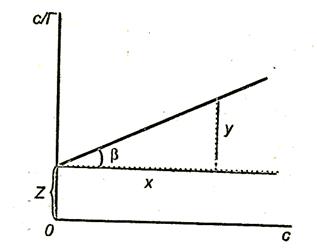
Рис.3.8. Залежність величини с / Г від концентрації ПАР.
Доведено, що До в рівнянні Шишковського (питома капілярна постійна) і К в рівнянні Ленгмюра (константа адсорбційної рівноваги) - це одна і та ж величина.
Побудувавши графік. можна знайти граничну адсорбцію і константу адсорбційної рівноваги К.
Так як адсорбція розглядається як псевдохіміческая реакція, на основі хімічної термодинаміки можна записати
Шишковський емпіричним шляхом встановив, що константа К збільшується в 3 3,5 рази при подовженні ланцюга на одну ланку -СН2.
Напишемо вираз для різниці робіт адсорбції двох сусідніх членів гомологічного ряду.
= 8,31 * 298 * In 3,5 3,2 кДж / моль,
де n - число атомів вуглецю в вуглеводневому радикала.
Це означає, що для перекладу кожної - СН2- групи з поверхневого шару в об'ємну фазу треба затратити 3,2 кДж / моль енергії. Це робота розсування диполів води на величину обсягу - СН2- групи - величина адитивна і однакова для різних рядів аліфатичних граничних з'єднань. Постійна різниця робіт адсорбції для двох сусідніх членів перетворюється в постійне відношення (3 3,5), яке фігурує в правилі Дюкло- Траубе. Сутність цього правила, таким чином, полягає в тому, що робота адсорбції на кожну - СН2- групу є постійною, близькою до 3,5 кДж / мол'.
На закінчення відзначимо, що крім рівняння Гіббса, Шишковського і Ленгмюра існує рівняння Фрумкіна, що дозволяє розрахувати зміна поверхневого натягу в результаті адсорбції: