2.15 Гідроліз як обмінний процес
Ви знаєте, що, відповідно до теорії електролітичноїдисоціації, у водному розчині частинки розчиненої речовини взаємодіють з молекулами води. Така взаємодія може привести до реакції гідролізу (від грецького hydro - вода, lysis - розкладання, расіад).
Гідроліз - це реакція обмінного розкладання речовин водою.
Гідролізу піддаються різні речовини: неорганічні - солі, карбіди і гідриди металів, галогеніди неметалів; органічні - галогеналкани. складні зфіри і жири, вуглеводи, білки, полінуклеотіди.
Реакції гідролізу можуть протікати оборотно і необоротно. Розглянемо різні випадки цього процесу і його значення.
Гідроліз органічних речовин
1. Гідроліз галогеналканов використовують дли отримання спиртів.
Присутність лугу (ОН) дозволяє «зв'язати» утворюється кислоту і змістити рівновагу в бік утворення спирту.
2. Гідроліз складних зфіров протікає оборотно в кислотному середовищі (у присутності неорганічної кислоти) з утворенням відповідного спирту і карбонової кислоти.
Для зміщення хімічне рівновазі в бік продуктів реакції гідроліз проводять в присутності лугу.
Історично першим прикладом такої реакції було лужне розщеплення складних ефірів вищих жирних кислот, що призвело до отримання мила. Це сталося в 1811 р коли французький вчений Е. Шеврель. нагріваючи жири з водою в лужному середовищі, отримав гліцерин і мила - солі вищих карбонових кислот. На підставі цього експерименту було встановлено склад жирів, вони виявилися складними ЗФІ-рами, але тільки «тричі складними. похідними трехатомного спирту гліцерину - трігліцерідамн. А процес гідролізу складних ефірів в лужному середовищі до цих пір називають «омиленням» .Наприклад, омилення ефіру, утвореного гліцерином, пальмітинової і стеаринової кислотами:
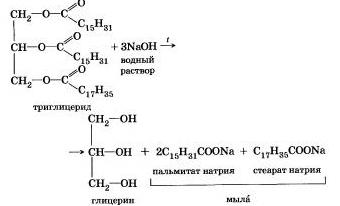
Натрієві солі вищих карбонових кислот - основні компоненти твердого мила, калієві солі - рідкого мила.
Французький хімік М. Бертло в 1854 р здійснив реакцію етерифікації і вперше синтезував жир. Отже, гідроліз жирів (як і інших складних ефірів) протікає оборотно. Рівняння реакції можна спрощено записати так:
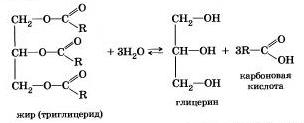
В живих організмах відбувається ферментативний гідроліз жирів. У кишечнику під впливом ферменту ліпази жири їжі гідратізуются на гліцерин і органічні кислоти, які всмоктуються стінками кишечника, і в організмі синтезуються нові жири, властиві даному організму. Вони по лімфатичної системи надходять в кров, а потім в жирову тканину. Звідси жири надходять в інші органи і тканини організму, де в процесі обміну речовин в клітинах знову гідролізуються і потім поступово окислюються до оксиду вуглецю і води з виділенням енергії, необхідної для життєдіяльності.
У техніці гідроліз жирів використовують для отримання гліцерину, вищих карбонових кислот, мила.
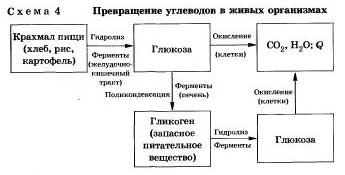
3. Як ви знаєте, вуглеводи є найважливішими компонентами нашої їжі. Причому ди- (сахароза, лактоза, мальтоза) і полісахариди У лабораторних і промислових умовах в якості каталізатора цих процесів використовують кислоту. Реакції здійснюють при нагріванні.
Реакцію гідролізу крохмалю до глюкози при каталітичному дії сірчаної кислоти здійснив в 1811 р український вчений К. С. Кирхгоф.
В організмі людини і тварин гідроліз вуглеводів відбувається під дією ферментів (схема 4).
Промисловим гідролізом крохмалю отримують глюкозу і патоку (суміш декстринів, мальтози і глюкози). Патоку застосовують в кондитерській справі.
Декстрини як продукт часткового гідролізу крохмалю мають клеїть дією: з ними пов'язана поява скориночки на хлібі і смаженому картоплі, а також утворення щільної плівки на накралмаленном білизна під дією гарячої праски.
Ще один відомий вам полісахарид - целюлоза - також може гидролизоваться до глюкози при тривалому нагріванні з мінеральними кислотами. Процес йде поступово, але коротко. Цей процес лежить в основі багатьох гідролізних виробництв. Вони служать для отримання харчових, кормових і технічних продуктів з нехарчової раститель сировини - відходів лісозаготівель, деревообробки (тирса, стружка, тріска), переробки сільськогосподарських культур (соломи, лушпиння насіння, качанів кукурудзи і т. Д.).
Технічними продуктами таких виробництв є гліцерин, етиленгліколь. органічні кислоти, кормові дріжджі, етиловий спирт, сорбіт (шестиатомний спирт).
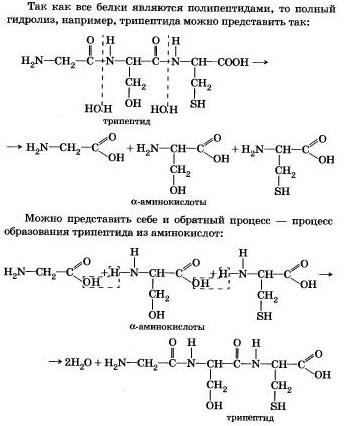
4. Ви знаєте, що білки-біополімери - основа життя всіх живих організмів (від вірусу до людини) - складаються головним чином з амінокислот (найбільш часто зустрічаються 20). Встановлення послідовності розташування залишків амінокислот, складових молекулу білка, є первинною метою при дослідженні його структури. І встановити її допомагає ступінчастий гідроліз білка, який здійснюють при нагріванні з кислотами або лугами, а також при дії ферментів.
5. Незмірно важливу роль в організмі відіграє процес гідролізу аденозинтрифосфорної кислоти (ЛТФ). Ця речовина служить джерелом енергії для всіляких біохімічних реакцій (побудови білка, скорочення м'язів і ін.). При гідролізі АТФ до аденозіндіфосфорной кислоти (АДФ) енергія вивільняється.
Зворотний процес утворення АТФ з АДФ протікає з поглинанням енергії. Отже. АТФ це універсальне енергетичне речовина клітини.
Водні розчини солей мають різні значення ph і різні типи середовищ - кислотну (рН <7), щелочную (рН> 7), нейтральну (рН = 7). Це пояснюється тим. що солі у водних розчинах можуть піддаватися гідролізу.
Сутність гідролізу зводиться до обмінного хімічної взаємодії катіонів або аніонів солі з молекулами води. В результаті цієї взаємодії утворюється малодіссо-ціірующее з'єднання (слабкий електроліт). А у водному розчині солі з'являється надлишок вільних іонів Н або ОН + і розпір солі стає кислотним або лужним відповідно.
Будь-яку сіль можна уявити як продукт взаємодії підстави з кіслотой.В залежності від сили підстави і кислоти можна виділити 4 типи солей (схема 6).
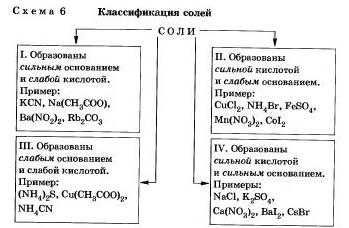
Розглянемо поведінку солей різних типів в розчині
I. Солі, утворені сильною основою і слабкою кислотою
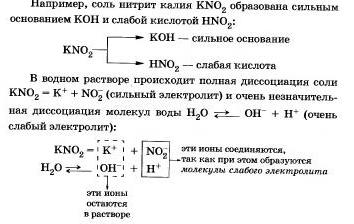
Цей процес звернемо, хімічне рівновагу зміщений вліво (в сторону утворення вихідних речовин), так як вода - значно більш слабкий електроліт, ніж азотистая кислота.
Скорочена іонне рівняння гідролізу поколює, що:
а) в розчині є вільні гідроксоіони ОН і концентрація їх більше, ніж в чистій воді, тому розчин солі KN02 має лужне середовище (рН> 7);
б) в реакції з водою беруть участь аніони N02-; в такому випадку говорять, що йде гідроліз за аніоном.
Інші приклади аніонів, які беруть участь в реакції з водою:
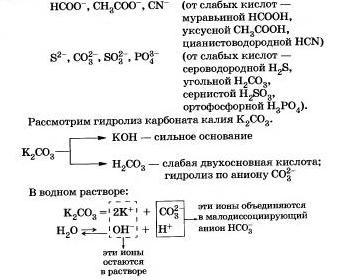
Підіб'ємо підсумок того, що ви дізналися про гідролізі по аніону:
а) у аниону солі, як правило, гідролізуються оборотно;
б) хімічну рівновагу в таких реакціях сильно зміщене вліво;
в) реакція середовища в розчинах подібних Солм лужна (рН> 7);
г) при гідролізі солей, утворених слабкими багатоосновними кислотами, виходять кислі солі.
Солі, утворені сильною кислотою і слабкою основою.
Наприклад, розглянемо гідроліз йодиду амонію NН4I.
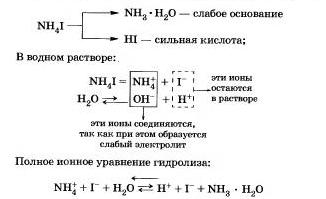
Процес звернемо, хімічна рівновага зміщена в бік утворення вихідних речовин, так як вода Н20 значно більш слабкий електроліт, ніж гідроксид амонію.
Рівняння показує, що:
а) в розчині є вільні іони водню Н і їх концентрація більше, ніж в чистій воді, тому розчин солі має кислотну середу (рН <7);
б) в реакції з водою беруть участь катіони амонію; в такому випадку говорять, що йде гідроліз по катіону.
В реакції з водою можуть брати участь і багатозарядні катіони: двозарядні М2 +. крім катіонів лужноземельних металів, трехзарядние Ме3 +.
Розглянемо гідроліз хлориду нікелю NiСl2.
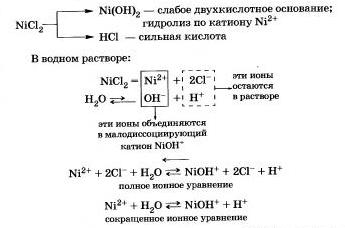
Продукти гідролізу - основна сіль Ni0НСl і соляна кислота НСl.
Серед водних розчину хлориду нікелю кислотна (рН <7), потому что в растворе увеличивается концентрация ионов
Гідроліз солі Ni0НСl протікає в значно меншому ступені, і їм можна знехтувати.
Підіб'ємо підсумок того, що ви дізналися про гідролізі по катіону:
а) за катіоном солі, як правило гідролізуються оборотно
б) хімічну рівновагу реакцій зміщується вліво
III. Солі, утворені слабкою основою і слабкою кислотою.
Вам, очевидно, вже ясно, що такі солі піддаються гідролізу по катіону, і по аніону.
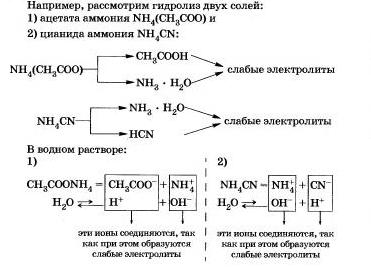
Як ви вже помітили, гідроліз більшості солей є оборотним процесом. Однак деякі солі повністю розкладаються водою, т. Е. Їх гідроліз є незворотнім процесом.
висновки:
а) якщо солі гідролізуються і по катіону, і але аниону оборотно, то хімічна рівновага в реакціях гідролізу зміщене вправо;
б) реакція середовища при цьому або нейтральна, або слабокислотні, або слаболужна, що залежить від співвідношення констант дисоціації утворюється підстави і кислоти;
в) солі можуть гидролизоваться і по катіону, і по аніону необоротно, якщо хоча б один з продуктів гідролізу йде зі сфери реакції.
IV. Солі, утворені сильною основою і сильною кислотою, що не піддаються гідролізу. До цього висновку ви дійшли, очевидно, самі.
Розглянемо «поведінку» в розчині хлориду калію КСl.
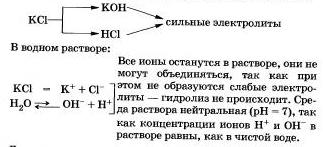
Іншими прикладами подібних солей можуть бути нітрати, перхлорати, сульфати, хроміти і дихромати лужних металів, галогеніди (крім фторидів), нітрати і перхлорати лужноземельних металів.
Узагальнимо інформацію про гідролізі солей в таблиці 14. Слід також зазначити, що реакції оборотного гідролізу повністю підкоряються принципу Ле-Шательє. Тому гідроліз солі можна посилити (і навіть зробити необоротним) наступними способами:
а) додати води (зменшити концентрацію);
б) нагріти розчин, при цьому посилюється ендотермічна дисоціація води, а значить, збільшується кількість іонів Н і ОН. які необхідні для здійснення гідролізу солі;

в) зв'язати один з продуктів гідролізу в важкорозчинні сполуки або видалити один з продуктів в газову фазу; наприклад, гідроліз ціанід амонію буде значно посилюватися за рахунок розкладання гідрату аміаку з утворенням аміаку, і води.
Гідроліз можна придушити (значно зменшити кількість піддається гідролізу солі:
а) збільшити концентрацію розчиненої речовини
б) охолодити розчин;
а) ввести в розчин один з продуктів гідролізу; наприклад, окисліться розчин, якщо його реакція в результаті гідролізу кислотна, або подщелачивать, якщо - лужна.
Гідроліз солей має і практичне, і біологічне значення
Ще в давнину в якості миючого засобу використовували золу. В золі міститься карбонат калію, який у воді гідролізується за аніоном, водний розчин набуває милкость за рахунок утворюються при гідролізі іонів ОН.
В даний час в побуті ми використовуємо мило, пральні порошки та інші миючі засоби. Основний компонент мила - це натрієві або калієві солі вищих жирних карбонових кислот: стеарати, пальмітат, які гідролізуються.
До складу ж пральних порошків та інших миючих засобів спеціально вводять солі неорганічних кислот (фосфати, карбонати), які підсилюють миючу дію за рахунок підвищення рh середовища.
Солі, що створюють необхідну лужне середовище розчину, містяться в фотографічному проявнику. Це карбонат натрію, карбонат калію, бура та інші солі, гидролизующиеся але аниону.
Якщо кислотність грунту недостатня, у рослин з'являється хвороба - хлороз. Її ознаки - пожовтіння або побіління листя, відставання в рості і розвитку. Якщо рН> 7,5, то в неї вносять добриво сульфат амонію, яке сприяє підвищенню кислотності, завдяки гідролізу по катіону, що проходить в почве.Неоценіма біологічна роль гідролізу деяких солей, що входять до складу організму.
Зверніть увагу, що у всіх реакціях гідролізу ступеня окислення хімічних елементів не змінюються. Окислювально-відновні реакції до реакцій гідролізу зазвичай не відносять, хоча при цьому і відбувається взаємодія речовини з водою.
1. Виберіть приклади органічних речовин, що піддаються гідролізу:
глюкоза, етанол, Бромметан, формальдегід, сахароза, метиловий ефір мурашиної кислоти, стеаринова кислота, 2-метил бутан.
Складіть рівняння реакцій гідролізу; в разі оборотного гідролізу вкажіть умови, що дозволяють змістити хімічну рівновагу в бік утворення продукту реакції.
2. Які солі піддаються гідролізу? Яку середу можуть мати при цьому водні розчини солей? Наведіть приклади.
3. Які з солей піддаються гідролізу по катіону? Складіть рівняння їх гідролізу, вкажіть середу.
4. Які з солей піддаються гідролізу за аніоном?
5 *. Додавання яких з наведених нижче речовин до розчину хлориду заліза (ІІІ) посилить гідроліз солі: HCI, NaOH, ZnCl2? Поясніть, будь ласка.
6. Запропонуйте способи придушення гідролізу водного розчину сульфіду калію.