
Блокатори міостатіна пригнічують дію міостатіна, специфічного білка, відповідального за регуляцію і обмеження зростання м'язової тканини. Це призводить до того, що м'язи будуть залишатися "накачаними", як ніби спортсмен щодня продовжує ходити в тренажерний зал, хоча насправді він давно припинив заняття.
Протягом останніх десятиліть пошуки шляхів відновлення і збільшення м'язової маси велися не тільки за допомогою низькомолекулярних анаболічних і антикатаболических препаратів, а також ДД, але і на рівні пошуку генів, відповідальних за гомеостаз м'язової тканини. Об'єктом для виявлення таких генів були, зокрема, породи м'ясної худоби з фенотипом так званої подвоєною м'язової маси (породи бельгійська блакитна і piedmontese)
Бик породи бельгійська блакитна. Поряд із значним збільшенням всіх м'язових груп видно практично повна відсутність підшкірної жирової тканини.


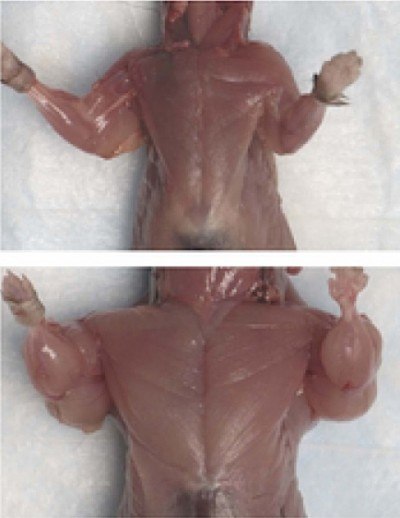
В результаті цих експериментів було доведено, що білок GDF-8 є негативним регулятором росту скелетних м'язів. Тому він отримав назву миостатин. а тварини з таким дефектом - миостатин -ноль миші.
Здатність міостатіна обмежувати ріст м'язової маси відразу привернула до нього увагу як до потенційної мішені для терапевтичного втручання при дегенеративних захворюваннях, травмах та інших патологіях м'язової системи, а також - для застосування в спортивній медицині та спорті.
Було встановлено, що миостатин за своєю структурою відноситься до білків типу TGF-beta (Transforming Growth Factor-beta, що трансформується фактор росту-бета), які представляють собою секретуються чинники, необхідні як в ході ембріогенезу, так і в дорослому стані для тканинного гомеостазу.
Миостатин має загальні структурні властивості з іншими білками сімейства TGF-beta:
гидрофобное ядро в районі N-кінцевій частині молекули, яке служить як секреторний сигнал;
консервативний блок з чотирьох амінокислот в С-кінцевий половині молекули, що є сигналом для процесингу (протеолітичного розщеплення в процесі утворення активного білка з попередника більшої довжини);
дев'ять залишків цистеїну в С-кінцевій частині молекули, необхідних для утворення функціонально активної вторинної структури. Після процесингу С-кінцевий домен, який стає функціонально активним миостатином. залишається нековалентно пов'язаних з N-кінцевою частиною молекули, яку в даному випадку називають пропептиду;
миостатин. як і інші білки типу TGF-beta, секретується у вигляді неактивного комплексу з пропептиду.
Процес експресії міостатіна. можливо, регулюється білком Titin-cap, так як встановлено, що синтез цього білка зменшує вихід міостатіна з клітин. Секретувати у вигляді комплексу з пропептиду миостатин неактивний, оскільки не може зв'язуватися зі своїм рецептором. Для прояву активності миостатин повинен бути відділений від пропептида. Активація міостатіна здійснюється в результаті розщеплення пропептида протеазами типу катепсина D.
Вважається, що основна маса синтезованого міостатіна проявляє свою дію аутокрінним і паракрінним чином, т. Е. Миостатин діє всередині синтезувала його клітини і в найближчому оточенні. Але недавно в експериментах доведена можливість прояву його активності ендокринних чином, т. Е. Системний вплив локально синтезованого міостатіна на всі м'язові групи.
Для прояву своєї дії миостатин повинен зв'язатися з відповідним йому рецептором. Показано, що миостатин взаємодіє з рецепторами активина ActRIIB. Миші з зміненими рецепторами ActRIIB, нездатними при зв'язуванні міостатіна передавати сигнал всередину клітини, також мають збільшеною мускулатурою, як і миостатин-нуль миші.
В ембріогенезі експресія гена міостатіна починається в прогеніторних клітинах миогенной лінії і триває у дорослих аксіальних і параксіальної м'язах. При цьому рівень синтезу міостатіна різний в різних скелетних м'язах.
Подальші дослідження виявили експресію гена міостатіна в ряді інших тканин. Показано, що миостатин знаходиться в кардіоміоцитах і волокнах Пуркіне в серце, синтез мРНК міостатіна виявлений в молочних залозах і адипоцитах.
Можна припускати, що статеві відмінності в кількості секретується міостатіна. поряд з іншими факторами, впливають на статевий диморфізм у розвитку скелетної мускулатури. При однаковому рівні синтезу мРНК міостатіна. т. е. рівні експресії гена міостатіна, рівень секретувати міостатіна вище у жінок, ніж у чоловіків.

Оскільки почалася в ембріогенезі експресія гена міостатіна триває в постнатальних м'язах і м'язах дорослого організму, то миостатин. мабуть, грає істотну роль на всіх стадіях міогенеза і в тканинному гомеостазі скелетної мускулатури в дорослому стані при впливі різних функціональних стимулів, включаючи знерухомлення.
Активація генів MyoD і Myf5 дає початок миогенной лінії клітин, прогеніторні клітини (клітини-попередники) дають початок міобласти. Активація гена міогеніна стимулює міобласти до поділу (проліферації) і подальшої диференціювання. Миостатин. активуючи ген р21 і синтез Smad-білків, обмежує (або зупиняє) проліферацію міобластів. Міобласти, які припинили поділ, переходять до стадії морфогенезу, т. Е. До закладки попередників м'язових волокон - myotubes. Взаємодіючи один з одним, вони шикуються в ланцюжки і зливаються в витягнуті багатоядерні клітини (синцитії). Після злиття починаються диференціювання мембран, біохімічна та цитоплазматическая диференціювання, в результаті чого виникають остаточно сформовані зрілі м'язові волокна.
Зрілі м'язові волокна є продуктом кінцевої диференціювання, т. Е. Ні вони самі, як структура в цілому, ні клітинні ядра всередині волокон не можуть ділитися і зростання і регенерація м'язів здійснюються завдяки npoліфераціі клітин-сателітів. Клітини-сателіти мають розміри, близькі до розмірів клітинних ядер м'язових волокон і, як і ці ядра, знаходяться на периферії м'язових волокон. Тільки електронна мікроскопія дозволила встановити, що вони фізично відокремлені від зрілих м'язових волокон і знаходяться між сарколеммой і базальноїмембраною.
В м'язових волокнах кількість цитоплазми, що припадає на одне ядро, знаходиться в певних досить вузьких межах (Міон-клеарний домен). Збільшення розмірів волокна (гіпертрофія) досягається завдяки злиттю проліферуючих клітин-сателітів з волокном, так що розміри міонуклеарного домену залишаються в тих же межах, що і до гіпертрофії. Стимулом для поділу (проліферації) клітин-сателітів у дорослих організмів є перш за все травма, в тому числі на рівні окремого м'язового волокна. Виходячи зі стану спокою, клітини-сателіти починають експресувати міогенні маркери, т. Е. Активуються гени, характерні для міобластів. У процесі регенерації пошкоджених скелетних м'язів клітини-сателіти зливаються з існуючими м'язовими волокнами (гіпертрофія) або між собою, створюючи нові волокна (гіперплазія).
Визначаючи частку клітин-сателітів в м'язовій тканині, зручніше зіставляти міофібрили і клітини-сателіти по числу ядер, оскільки м'язові волокна багатоядерних. У дорослому стані ядра клітин-сателітів становлять 2-7% загального числа ядер в різних м'язах. При народженні ядра клітин-сателітів становлять близько 30% загального числа ядер в м'язах нижніх кінцівок. Ці неонатальні клітини-сателіти пролиферируют і зливаються зі зростаючими м'язовими волокнами, привносячи в них додаткові ядра в ході постнатального росту скелетних м'язів.
У відповідь на міотравму клітини-сателіти активуються і проліферують. Частина клітин після поділу повертається в стан спокою (для відновлення пулу клітин-сателітів). Основна частина клітин в результаті хемотаксису мігрує до ушкоджених ділянок і в залежності від ступеня пошкодження або зливається з пошкодженим м'язовим волокном або клітини-сателіти зливаються один з одним, утворюючи нові волокна. Ядра недавно злилися клітин-сателітів знаходяться в центрі волокон. У міру відновлення внутрішньоклітинних структур волокна вони мігрують до периферії.
Таким чином, клітини-сателіти забезпечують підтримку функціонального стану скелетних м'язів дорослого організму. Вони необхідні для відновлення пошкоджених м'язових волокон і є джерелом додаткових ядер при гіпертрофії м'язів в результаті тренувальних занять. Гіпертрофія і (або) гіперплазія скелетних м'язів у тварин з відсутністю функціонально активного міостатіна доводить, що миостатин впливає на проліферацію клітин-сателітів, оскільки постнатальний зростання м'язів і збільшення числа ядер в м'язових волокнах в процесі розвитку до дорослого стану відбувається за рахунок проліферації клітин-сателітів .
При активації клітин-сателітів (вихід зі стану спокою) в них починають працювати гени, характерні для міобластів і, таким чином, клітини-сателіти стають миобластами. Ступінь проліферації клітин-сателітів у дорослих м'язах також обмежується миостатином, як і проліферація міобластів в ембріогенезі. Показано, що і білок TGF-beta інгібуєпроліферацію клітин-сателітів в культурі.
Роль міостатіна в гомеостазі зрілих м'язових волокон в повній мірі поки не з'ясована, але є ряд робіт з дослідження рівня синтезу як мРНК міостатіна. так і самого міостатіна в м'язах в дорослому стані на тваринних моделях і у людини при різних фізіологічних станах.
Так, системна надекспресія міостатіна у мишей протягом двох тижнів призводить до втрати понад 30% загальної маси тіла і 50% м'язової маси, т. Е. Картина практично ідентична синдрому кахексії у людини. Встановлено, що миостатин може діяти ендокринних чином. Введення інгібіторів міостатіна пропептида або фоллістатіна значно уповільнює втрату м'язової маси при підвищеному рівні міостатіна.
Також важливо відзначити, що поряд з втратою м'язової маси відбувається практично повна втрата підшкірного жиру, що також узгоджується з даними про вплив міостатіна на диференціювання адипоцитів.

Внутрішньом'язова і сироваткова концентрації міостатіна збільшені у хворих на СНІД в стадії, коли спостерігається втрата м'язової маси. При цьому концентрація міостатіна обернено пропорційно корелює з індексом чистої маси тіла. Ці результати показують, що миостатин вносить вклад у втрату м'язової маси при СНІДі, а також про те, що блокатори міостатіна можуть бути корисні в медицині.
У прямих експериментах на щурах виявлено, що втрата м'язової маси, яка відбувається при космічному польоті, пов'язана зі збільшенням рівня міостатіна в скелетних м'язах (2-5-кратне в різних м'язах до 17-го дня польоту). Ці результати показують, що миостатин один з основних елементів в багатофакторної патофізіології відбувається в умовах космічного польоту м'язової атрофії.
У наземних дослідженнях за участю людей встановлено, що до 25-го дня нерухомого режиму (в якості моделі космічного польоту) рівень міостатіна підвищується на 12%.
Іммобілізація м'язів у мишей призводить до збільшення концентрації мРНК міостатіна (експресії гена міостатіна) в знерухомлених м'язах уже через 24 год експерименту, хоча втрата м'язової маси починається лише після третього дня. Найбільш несподіваний результат, отриманий в цих експериментах, полягав у тому, що синтез міостатіна значно відрізнявся в м'язах, що містять різні ізоформи (варіанти) важкого ланцюга міозину. При іммобілізації синтез міостатіна значно зростав в бистросокращающихся м'язових волокнах, які атрофувалися до сьомого дня на 17%, в той час як m. soleus, в якій синтез міостатіна не виявлявся, атрофировалась до того ж дня на 42%. М. soleus складається тільки з волокон типів I і Па, тоді як m. gastrocnemius і т. plantaris окреслити основні IId / г і IIЬ, хоча і містять типи I і На. Єдино прийнятне пояснення цього феномена - вплив міостатіна, синтезованого m. gastrocnemius і га. plantaris, на m. soleus, т. е. ендокринне вплив.
Інше пояснення полягає в тому, що синтез міостатіна корелює з типом волокон, т. Е. Синтез міостатіна при іммобілізації м'язів у мишей корелює з изоформой важкого ланцюга міозину IIb.
На моделі м'язової дистрофії Дюшена (миші лінії mdx) показано, що блокатори міостатіна (шляхом внутрішньочеревно ін'єкцій антитіл до миостатин) протягом трьох місяців призводить до збільшення м'язової маси, розмірів і сили м'язів. Гібриди мишей лінії mdx з миостатин -ноль мишами мають значно кращий стан мускулатури, ніж вихідні миші лінії mdx. Нормалізація стану м'язів у мишей лінії mdx шляхом блокади міостатіна або схрещування з миостатин -ноль мишами відкриває нові можливості для лікування патологій, що супроводжуються втратою м'язової маси.
Понад сорок років тому було висловлено припущення про існування тканеспецифических інгібіторів - кейлонов (chalones), які, синтезуючи даної тканиною, інгібують її зростання і, таким чином, підтримують адекватну масу цієї тканини. Це припущення згодом підтвердилося в разі скелетної мускулатури.
Джерело: Загальний розділ (Сейфулла)
