Якщо говорити більш строго, то відносне розташування підрівнів обумовлено не стільки їх більшою або меншою енергією, скільки вимогою мінімуму повної енергії атома.
Розподіл електронів по атомним орбиталям відбувається, починаючи з орбіталі, що має найменшу енергію (принцип мінімуму енергії), тобто електрон сідає на найближчу до ядру орбиталь. Це означає, що спочатку заповнюються електронами ті підрівні, для яких сума значень квантових чисел (n + l) була мінімальною. Так енергія електрона на 4s-підрівні менше енергії електрона, що знаходиться на 3d-підрівні. Отже, заповнення електронами підрівнів відбувається в наступному порядку: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d
4f <6p <7s <6d
Виходячи з цієї вимоги, мінімум енергії досягається у більшості атомів тоді, коли їх підрівні заповнюються в показаної вище послідовності. Але є й винятки, які ви можете знайти в таблицях "Електронні конфігурації елементів", однак ці винятки рідко доводиться брати до уваги при розгляді хімічних властивостей елементів.
Атом хрому має електронну конфігурацію НЕ 4s 2 3d 4. a 4s 1 3d 5. Це є прикладом того, як стабілізація станів з паралельними спинами електронів переважає над незначною різницею енергетичних станів підрівнів 3d і 4s (правила Гунда), тобто енергетично вигідними станами для d-підрівні є d 5 і d 10. Енергетичні діаграми валентних підрівнів атомів хрому і міді представлені на рис.2.1.1.
Подібний перехід одного електрона з s-підрівні на d-підрівень відбувається ще у 8 елементів: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd відбувається перехід двох s-електронів на d-підрівень: Pd 5s 0 4d 10.
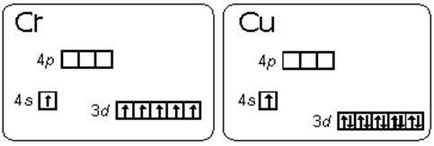
Рис.2.1.1. Енергетичні діаграми валентних підрівнів атомів хрому і міді
Правила заповнення електронних оболонок:
1. Спочатку з'ясовуємо, скільки всього електронів містить атом даного нас елемента. Для цього достатньо знати заряд його ядра, який, завжди дорівнює порядковому номеру елемента в Періодичної таблиці Д. І. Менделєєва. Порядковий номер (число протонів в ядрі) в точності дорівнює і числу електронів в усьому атомі.
2. Послідовно заповнюємо орбіталі, починаючи з 1s-орбіталі, наявними електронами, враховуючи принцип мінімальної енергії. При цьому не можна розташовувати на кожній орбіталі більше двох електронів з протилежно спрямованими спинами (правило Паулі).
3. Записуємо електронну формулу елемента.
Атом - це складна, динамічно стійка мікросистема взаємодіючих частинок: протонів р +. нейтронів n 0 і електронів е -.
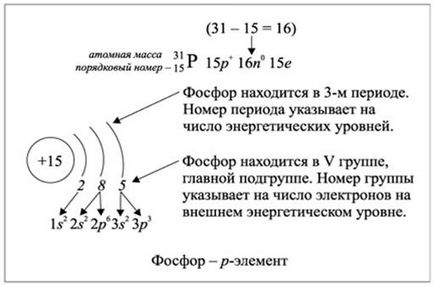
Ріс.2.1.2. Заповнення енергетичних рівнів електронами елемента фосфору
Електронну структуру атома водню (z = 1) можна зобразити таким чином:
+1 Н 1s 1. n = 1 ↑, де квантова комірка (атомна орбіталь) позначається у вигляді лінії або квадрата, а електрони - у вигляді стрілок.
Кожен атом подальшого хімічного елемента в періодичній системі є Багатоелектронні атом.
Атом літію, так само як і атом водню і гелію, має електронну структуру s-елемента, тому що останній електрон атома літію «сідає» на s-підрівень:
В атомі бору з'являється перший електрон в p-стані:
Запис електронної формули простіше показати на конкретному прикладі. Припустимо, нам треба з'ясувати електронну формулу елемента з порядковим номером 7. В атомі такого елемента має бути 7 електронів. Заповнимо орбіталі сім'ю електронами, починаючи з нижньої 1s-орбіталі.
Отже, 2 електрона розташуються на 1s-орбіталі, ще 2 електрона - на 2s-орбіталі, а решту 3 електрона зможуть розміститися на трьох 2p-орбіталях.
Електронна формула елемента з порядковим номером 7 (це елемент азот, який має символ "N") виглядає так:
Розглянемо дію правила Гунда на прикладі атома азоту: N 1s 2 2s 2 2p 3. На 2-му електронному рівні є три однакових p-орбіталі: 2px, 2py, 2pz. Електрони заселять їх так, що на кожній з цих p-орбіталей виявиться по одному електрону. Пояснюють це тим, що в сусідніх осередках електрони менше відштовхуються одна від одної, як однойменно заряджені частинки. Отримана нами електронна формула азоту несе дуже важливу інформацію: 2-й (зовнішній) електронний рівень азоту заповнений електронами не до кінця (на ньому 2 + 3 = 5 валентних електронів) і до повного заповнення не вистачає трьох електронів.
Зовнішнім рівнем атома називається найдальший від ядра рівень, на якому є валентні електрони. Саме ця оболонка стикається при зіткненні з зовнішніми рівнями інших атомів в хімічних реакціях. При взаємодії з іншими атомами азот здатний прийняти 3 додаткових електрона на свій зовнішній рівень. При цьому атом азоту отримає завершений, тобто максимально заповнений зовнішній електронний рівень, на якому розташуються 8 електронів.
Завершений рівень енергетично вигідніше незавершеного, тому атом азоту повинен легко реагувати з будь-яким іншим атомом, здатним надати йому 3 додаткових електрона для завершення його зовнішнього рівня.
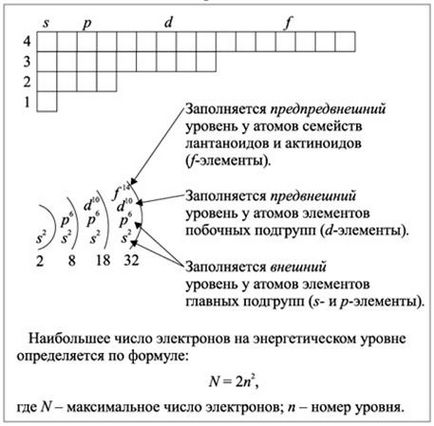
Ріс.2.1.3. Заповнення енергетичних рівнів у s-, p-, d- і f- елементів електронами