Як і інші функціональні білки, ферменти діляться на прості і складні. Прості ферменти - це прості білки, вони побудовані з амінокислот і при гідролізі розпадаються тільки на амінокислоти. Складні ферменти - це складні білки, вони складаються з простого білка і небілкового компонента. При їх гідролізі, крім вільних амінокислот, звільняється небілкова частина або продукти її розпаду.
Білкова частина складного ферменту отримала назву апофермент, небілкова частина - кофактор. Кофактори можуть мати різну хімічну природу і відрізнятися по міцності зв'язку з апоферментом. У ролі кофактора можуть виступати іони різних металів, а також інші неорганічні іони.
Органічні речовини неамінокіслотной природи, які використовуються в ролі кофакторів, називаються коферментами. Кофермент разом з апоферментом утворюють холоферменту.
Кофермент + Апофермент ↔ холоферменту
У деяких випадках в умовах живої клітини рівновагу в цій реакції сильно зрушено вправо і кофермент міцно пов'язаний зі своєю білкової частиною, вони не розділяються при виділенні і очищенні. Такий кофермент називається простетичної групою.
Слід зазначити одну відмінну рису складних ферментів, яка полягає в тому, що ні кофактор (в тому числі кофермент), ні сам по собі апофермент каталітичної активністю не володіють і тільки їх об'єднання в єдине ціле забезпечує швидке протікання хімічної реакції.
Коферменти відносяться до складних органічних речовин, їх молекули значно менше за розміром, ніж молекули ферментів. Коферменти можуть проникати через біологічні мембрани, нагрівання зазвичай не викликає зміни їх структури.
Функцією коферменту є участь в каталізуються реакції, причому кількість ферменту і його хімічну будову зовні залишаються незмінними. Насправді кофермент є одним з субстратів ферментативної реакції, тобто виступає як косубстрата. В ході реакції кофермент зазнає хімічні перетворення, в точності протилежні тим, які відбуваються в субстраті. Наприклад, в окисно-відновних реакціях молекула субстрату окислюється, а молекула коферменту відновлюється. При наступних сполучених реакціях зміни в коферменти протікають у зворотному напрямку і він відтворюється в первісній формі.
Таким чином, коферменти можуть бути охарактеризовані як переносники певних атомів, електронів або хімічних груп на відповідний акцептор. Будова апофермента визначає специфічність цієї реакції, а будова коферменту - її тип.
За походженням і хімічною будовою коферменти можна поділити на вітамінсодержащіе (вітамінні) і невітамінние. До першої групи належать похідні водорозчинних вітамінів групи В. До їх складу можуть входити також аденілові нуклеотиди. Особливості структури і функції вітамінних коферментів наведені в таблиці.
До невітамінним коферментам відносяться в першу чергу пептидні і нуклеотидні коферменти.
Глутатіон - кофермент пептидної природи. За хімічною будовою це трипептид # 947; -глутаміл-цистеїн-гліцин. Його реакційна здатність визначається SH-групою цистеїну, яка легко вступає в окислювально-відновні реакції. Тому глутатіон може перебувати у відновленій (Г-SH) і окисленої (Г-S-S-Г) формі. У клітці глутатіон присутній переважно у відновленій формі. Його основна функція полягає в тому, що глутатіон захищає SH-групи ферментів від окислення і утворює Меркаптани з дисульфідів.
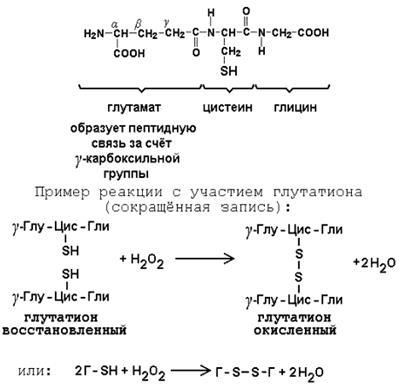
Малюнок 6 - Реакції з глутатионом
АТФ (АТФ) - кофермент нуклеотидной природи. У його склад входить пуриновое підставу аденін, вуглевод рибоза і три залишку фосфорної кислоти. Це з'єднання містить багаті енергією (макроергічні) фосфатні зв'язку та може брати участь в реакціях синтезу складних речовин, а також служити донором фосфатної групи.
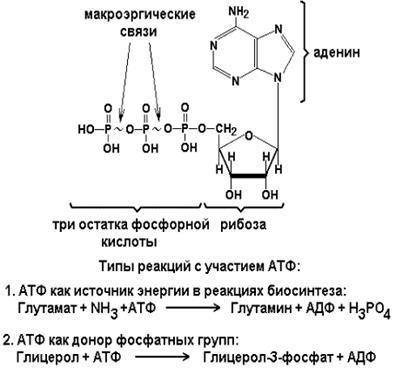
Малюнок 7 - АТФ (АТФ)
Небілкова частина складного ферменту може бути представлена також іонами металів. Ферменти, що містять в своєму складі іони металів, називаються металлоферментов (наприклад, # 945; -амилаза включає до свого складу іони Са2 +, які беруть участь в стабілізації просторової структури ферменту). Видалення цих іонів призводить до втрати активності ферменту. В інших випадках іони металів можуть служити активаторами ферментів - реакція може відбуватися і за відсутності цих іонів.
Багато коферменти і простетичної групи ферментів є похідними вітамінів - органічних речовин, які не синтезуються в організмі людини і повинні надходити в складі харчових продуктів. Вони називаються вітамінними коферментами. У молекулі такого коферменту активним компонентом, що з'єднується з яку переносять групою, служить саме вітамін. Інша частина молекули коферменту забезпечує специфічне зв'язування з апоферментом в строго певній орієнтації. Захворювання, які виникають у людей при нестачі вітамінів в їжі, є наслідком порушень обміну речовин, в результаті зниження концентрації коферментів специфічних ферментативних реакцій.
Найважливішими з вітамінних коферментів є:
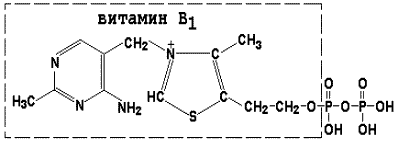
Тіаміндифосфат (ТДФ) є похідним вітаміну В1; бере участь в реакціях окисного декарбоксилювання піровиноградної і # 945; -кетоглутаровой кислот. Його формула приведена на малюнку.
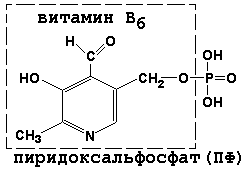
Піридоксальфосфат є похідним вітаміну В6; він бере участь в реакціях трансамінування амінокислот. Його формула приведена на малюнку.
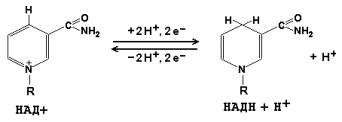
Коферменти НАД + (никотинамидадениндинуклеотид) і НАДФ + (нікотинамідаденіндінуклеотидфосфат) містять в своєму складі вітамін РР і беруть участь в окисно-відновних реакціях. Відновлені форми цього коферменту позначається НАДН і НАДФН відповідно. Формула коферменту НАД + представлена на малюнку; структура НАДФ + відрізняється наявністю додаткової фосфатної групи у другій позиції рибози аденілового нуклеотиду.
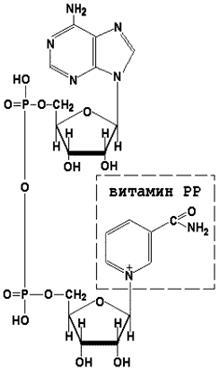
Освіта відновлених форм нікотинамідних коферментів представлено на схемі:
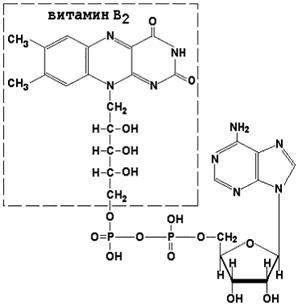
Коферменти ФАД (флавінаденіндінуклеотід) і ФМН (флавинмононуклеотид) містять в своєму складі вітамін В2 і беруть участь в окисно-відновних реакціях. Відновлені форми цього коферменту позначається ФАДН2 і ФМНН2 відповідно.
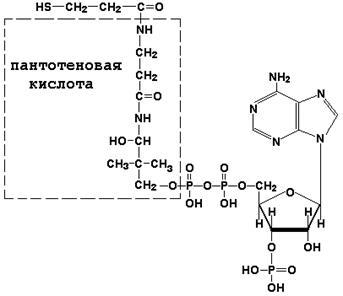
Коензим А (КоА-SH) є похідним вітаміну В3 (пантотенової кислоти) і бере участь в реакціях переносу залишків жирних кислот (реакціях ацилювання).
5,6,7,8-тетрагідрофолієвої кислота (ТГФК) є похідним вітаміну Вс (фолієвої кислоти) і бере участь в реакціях переносу одноуглеродних груп: метильной (СН3-), метиленової (-СН2-), метенільной (СН =), формільной (-СОН) і деяких інших.
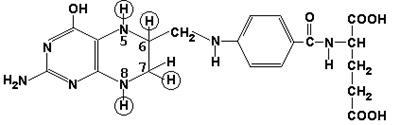
Метилкобаламін (містить вітамін В12) і також бере участь в перенесенні метильної групи.
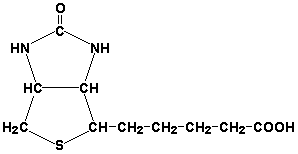
Біотин (вітамін Н) бере участь в активації СО2 і перенесення карбоксильних груп (реакціях карбоксилювання).
В даний час відомо більше двох тисяч хімічних реакцій, що каталізуються ферментами, і число це безперервно зростає. Щоб орієнтуватися в такій кількості перетворень. виникла нагальна потреба в систематизованої класифікації і номенклатурі, за допомогою якої будь-який фермент можна було б точно ідентифікувати. Номенклатура, якою користувалися до середини XX століття, була досить далека від досконалості. Дослідники, відкриваючи новий фермент, давали йому назву на свій розсуд, що неминуче вело до плутанини і всіляких протиріч. Деякі назви виявилися помилковими, інші нічого не говорили про природу каталізуються реакції. Вчені різних шкіл часто вживали різні назви для одного і того ж ферменту або, навпаки, одне і те ж назву для кількох різних ферментів.
В основу класифікації покладено найважливіша ознака, за яким один фермент відрізняється від іншого - це катализируемая їм реакція. Число типів хімічних реакцій порівняно невелика, що дозволило розділити всі відомі в даний час ферменти на 6 найважливіших класів, залежно від типу каталізуються реакції. Такими класами є:
оксидоредуктаз (окислювально-відновні реакції);
трансферази (перенесення функціональних груп);
гідролази (реакції розщеплення за участю води);
ліази (розрив зв'язків без участі води);
ізомерази (ізомерні перетворення);
лігази (синтез з витратою молекул АТФ).
Ферменти кожного класу ділять на підкласи, керуючись будовою субстратів. У підкласи об'єднують ферменти, що діють на схоже побудовані субстрати. Підкласи розбивають на подподкласса, в яких ще суворіше уточнюють структуру хімічних груп, що відрізняють субстрати один від одного. Усередині подподкласса перераховують індивідуальні ферменти. Всі підрозділи класифікації мають свої номери. Таким чином, будь-який фермент отримує свій унікальний кодовий номер, що складається з чотирьох чисел, розділених крапками. Перше число позначає клас, друге - підклас, третє - подподкласса, четверте - номер ферменту в межах подподкласса. Наприклад, фермент # 945; -амилаза, що розщеплює крохмаль, позначається як 3.2.1.1, де:
3 - тип реакції (гідроліз);
2 - тип зв'язку в субстраті (гликозидная);
1 - різновид зв'язку (О-гликозидная);
1 - номер ферменту в подподкласса.
Говорячи про класифікацію ферментів, слід також відзначити, що ферменти класифікуються не як індивідуальні речовини, а як каталізатори певних хімічних перетворень. Ферменти, виділені з різних біологічних джерел і каталізують ідентичні реакції, можуть істотно відрізнятися за своєю первинну структуру. Проте в класифікаційному списку всі вони фігурують під одним і тим же кодовим номером.
Знання кодового номера ферменту дозволяє:
усунути неоднозначності, якщо різні дослідники використовують один і той же назву для різних ферментів;
зробити пошук інформації в літературних базах даних більш ефективним;
отримати в інших базах даних додаткову інформацію про послідовність амінокислот, просторову структуру ферменту, генах, що кодують ферментні білки.
Система класифікації, розроблена Комісією по ферментам, включає також і новостворену номенклатуру ферментів, яка будується за спеціальними принципам. Згідно з рекомендаціями IUBMB, ферменти отримують два роду назв: систематичне і робоче (рекомендований). Систематичне назва складається з двох частин. Перша частина містить назву субстрату або субстратів, часто - найменування коферменту, друга частина вказує на природу каталізуються реакції і включає назву класу, до якого належить даний фермент. При необхідності наводиться додаткова інформація про реакцію в дужках після другої частини назви. Систематичне назва надається тільки тим ферментам, каталітична дія яких повністю вивчено.
Наприклад, систематичне назва # 945; -амілази - 1,4 # 945; -D-глюкан-глюканогідролаза. Звичайно, таку назву дуже незручно для запам'ятовування і проголошення. Тому поряд з систематичними Комісія по ферментам IUBMB рекомендує використовувати робочі (спрощені) назви ферментів.
Основні правила побудови систематичних і робочих назв різних класів ферментів:
Систематичне назва ферментів цього класу будується за схемою донор: акцептор - оксидоредуктаза. Згідно тривіальної номенклатурою, оксидоредуктаз, отщепляющие атоми водню або електрони і переносять їх на будь-який акцептор, крім кисню, називаються дегідрогеназ. Оксидоредуктази, що використовують кисень як акцептор атомів водню або електронів, називаються оксидазами. Деякі ферменти, які здатні переважно відновлює дію, звуться редуктаз. Всі перелічені назви можуть бути використані для побудови робочої назви оксидоредуктаз.
Систематичне назва ферментів, що прискорюють такі реакції, складають за формою донор: акцептор (яка транспортується група) трансфераза. У робочому назві зазвичай вказується тільки один специфічний субстрат або продукт поряд з назвою транспортується угруповання.
Систематичне назва складається за формою субстрат-гідролаза. У гидролаз, специфічно отщепляют певну групу, ця група може бути вказана у вигляді префікса. Робоча назва найчастіше складається з назви гідролізуемого субстрату з додаванням закінчення -аеа. Слід, однак, відзначити, що внаслідок досить складного і часто до кінця не виявленого характеру специфічності багатьох гідролаз не завжди вдається дати їм систематичне назва. У цих випадках рекомендовано використовувати емпіричні назви, присвоєні їм при першому описі. Так, не мають систематичного назви такі ферменти, як пепсин, папаїн, тромбін.
Систематичне назва ферментів будується за схемою: субстрат-отщепляют група-ЛіАЗ. Щоб уточнити, яка група відщеплюється, використовуються префікси "карбокси-", "аміак", "гідро-" і т.д. В якості робочих назв ферментів зберігаються тривіальні назви типу "декарбоксилаза", "альдолаза", "дегідратази", "десульфгідраза". Ліази діляться на підкласи в залежності від характеру розриваються зв'язків.
Систематичне назва ферментів включає назву субстрату і слово ізомерази, якому передує вказівка типу реакції ізомеризації. Робочі назви подібні (з деякими спрощеннями) систематичним назв.
Систематичне назва утворюється з назв з'єднуються субстратів в поєднанні зі словом лігаза. У дужках вказується продукт, що утворюється в результаті гідролізу нуклеозидтрифосфат. Робоча назва ферментів цього класу складається, як правило, з назви продукту реакції в поєднанні зі словом синтетаза.