електродні потенціали
В ОВР передача електронів восстановителями окислювача відбувається при безпосередньому контакті частинок, і енергія хімічної реакції переходить в теплоту. Енергія будь ОВР. протікає в розчині електроліту. може бути перетворена в електричну енергію. Наприклад, якщо окислювально-відновні процеси розділити просторово, тобто передача електронів відновником відбуватиметься через провідник електрики. Це реалізовано в гальванічних елементах, де електрична енергія виходить з хімічної енергії окисно-відновної реакції.
Розглянемо гальванічний елемент Даніеля-Якобі. в якому лівий посудину наповнений розчином сульфату цинку ZnSO4. з опущеною в нього цинкової платівкою, а правий посудину - розчином сульфату міді CuSO4. з опущеним в нього мідною пластинкою.
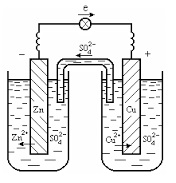
Взаємодія між розчином і пластиною, яка виступає в якості електрода, сприяє тому, щоб електрод придбав електричний заряд. Виникає на кордоні метал-розчин електроліту різниця потенціалів, називається електродним потенціалом. Його значення і знак (+ або -) визначаються природою розчину і знаходиться в ньому металу. При зануренні металів в розчини їх солей більш активні з них (Zn, Fe і ін.) Заряджаються негативно, а менш активні (Cu, Ag, Au і ін.) Позитивно.
Результатом з'єднання цинкової і мідної пластинки провідником електрики, є виникнення в ланцюзі електричного струму за рахунок перетікання електронів з цинкової до мідній пластинці по провіднику.
При цьому відбувається зменшення кількості електронів в цинку, що компенсується переходом Zn 2+ в розчин тобто відбувається розчинення цинкового електрода - анода (процес окислення).
У свою чергу, зростання кількості електронів в міді компенсується розрядженням іонів міді, що містяться в розчині, що призводить до накопичення міді на мідному електроді - катоді (процес відновлення):
Таким чином, в елементі відбувається така реакція:
Кількісно охарактеризувати окислювально-відновні процеси дозволяють електродні потенціали, виміряні щодо нормального водневого електрода (його потенціал прийнятий рівним нулю).
Щоб визначити стандартні електродні потенціали використовують елемент, одним з електродів якого є випробуваний метал (або неметалл), а іншим є водневий електрод. За знайденою різниці потенціалів на полюсах елемента визначають нормальний потенціал досліджуваного металу.
Окислювально-відновний потенціал
Значеннями окислювально-відновного потенціалу користуються в разі потреби визначення напрямку протікання реакції у водних або інших розчинах.
таким чином, щоб йодид-іони і іони заліза обмінювалися своїми електронами через провідник. У судини, що містять розчини Fe 3+ і I -. помістимо інертні (платинові або вугільні) електроди і замкнемо внутрішню і зовнішню ланцюг. У ланцюзі виникає електричний струм. Йодид-іони віддають свої електрони, які будуть перетікати по провіднику до інертного електроду, зануреному в розчин солі Fe 3+:
Процеси окислення-відновлення відбуваються у поверхні інертних електродів. Потенціал, який виникає на кордоні інертний електрод - розчин і містить як окислену, так відновлену форму речовини, називається рівноважним окислювально-відновним потенціалом. Значення окисно-відновного потенціалу залежить від багатьох факторів. в тому числі і таких як:
- Природа речовини (окислювача і відновника)
- Концентрація окисленої і відновленої форм. При температурі 25 ° С і тиску 1 атм. величину окисно-відновного потенціалу розраховують за допомогою рівняння Нернста:
E - окислювально-відновний потенціал даної пари;
E ° - стандартний потенціал (виміряний при Сік = Cвос);
R - газова постійна (R = 8,314 Дж);
T - абсолютна температура, К
n - кількість віддаються або одержуваних електронів в окислювально-відновному процесі;
F - постійна Фарадея (F = 96484,56 Кл / моль);
Сік - концентрація (активність) окисленої форми;
Cвос - концентрація (активність) відновленої форми.
Підставляючи в рівняння відомі дані і перейшовши до десяткового логарифму, одержимо такий вигляд рівняння:
- Кислотність розчину. Для пар, окислена форма яких містить кисень (наприклад, Cr2 O7 2. CrO4 2. MnO4 -) при зменшенні pH розчину окислювально-відновний потенціал зростає, тобто потенціал зростає з ростом H +. І навпаки, окислювально-відновний потенціал падає зі зменшенням H +.
- Температура. При збільшенні температури окислювально-відновний потенціал даної пари також зростає.
Стандартні окислювально-відновні потенціали представлені в таблицях спеціальних довідників. Слід мати на увазі, що розглядаються тільки реакції у водних розчинах при температурі ≈ 25 ° С. Такі таблиці дають можливість зробити деякі висновки:
- Величина і знак стандартних окисно-відновних потенціалів. дозволяють передбачити які властивості (окисні або відновлювальні) будуть проявляти атоми, іони або молекули в хімічних реакціях, наприклад
E ° (F2 / 2F -) = +2,87 В - найсильніший окислювач
E ° (K + / K) = - 2,924 В - найсильніший відновник
Дана пара буде володіти тим більшою відновлювальною здатністю, чим більше числове значення її негативного потенціалу, а окислювальна здатність тим вище, чим більше позитивний потенціал.
- Можливо визначити яке із з'єднань одного елемента буде мати найбільш сильним окислювальними відновні властивості.
- Можливо передбачити напрямок ОВР. Відомо, що робота гальванічного елемента має місце за умови, що різниця потенціалів має позитивне значення. Перебіг ОВР в обраному напрямку також можливо, якщо різниця потенціалів має позитивне значення. ОВР протікає в сторону слабших окислювачів і відновників з більш сильних, наприклад, реакція
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
Практично протікає в прямому напрямку, тому що
Cu + Fe 2+ = Cu 2+ + Fe
неможлива в прямому напрямку і протікає тільки справа наліво, тому що
В процесі ОВР кількість вихідних матеріалів зменшується, внаслідок чого Е окислювача падає, а E відновника зростає. При закінченні реакції, тобто при настанні хімічної рівноваги потенціали обох процесів вирівнюються.
- Якщо за даних умов можливе протікання кількох ОВР, то в першу чергу буде протікати та реакція, у якій різниця окисно-відновних потенціалів найбільша.
- Користуючись довідковими даними, можна визначити ЕРС реакції.
Отже, Як визначити ЕРС реакції?
Розглянемо кілька реакцій і визначимо їх ЕРС:
E ° (Mg 2+ / Mg) = - 2,36 В
E ° (Fe 2+ / Fe) = - 0,44 В
Щоб визначити ЕРС реакції, потрібно знайти різницю потенціалу окислювача і потенціалу відновника
ЕРС = Е 0 ок - Е 0 восст
- ЕРС = - 0,44 - (- 2,36) = 1,92 В
- ЕРС = 0,00 - (- 2,36) = 2,36 В
- ЕРС = + 0,34 - (- 2,36) = 2,70 В
Всі вищевказані реакції можуть протікати в прямому напрямку, тому що їх ЕРС> 0.
Константа рівноваги.
Якщо виникає необхідність визначення ступеня протікання реакції, то можна скористатися константою рівноваги.
Наприклад, для реакції
Zn + Cu 2+ = Zn 2+ + Cu
Застосовуючи закон діючих мас. можна записати
Тут константа рівноваги К показує рівноважний співвідношення концентрацій іонів цинку і міді.
Значення константи рівноваги можна обчислити, застосувавши рівняння Нернста
Підставами в рівняння значення стандартних потенціалів пар Zn / Zn 2+ і Cu / Cu 2+. знаходимо
Значення константи рівноваги показує, що реакція йде практично до кінця, тобто до того моменту, поки концентрація іонів міді не стане в 10 37,7 разів менше, ніж концентрація іонів цинку.
Константа рівноваги і окислювально-відновний потенціал пов'язані загальною формулою:
K - константа рівноваги
E1 0 і E2 0 - стандартні потенціали окислювача і відновника відповідно
n - число електронів, що віддаються відновником або прийнятих окислювачем.
Якщо E1 0> E2 0. то lgK> 0 і K> 1. Отже, реакція протікає в прямому напрямку (зліва направо) і якщо різниця (E1 0 - E2 0) досить велика, то вона йде практично до кінця.
Навпаки, якщо E1 0 Знаючи значення константи рівноваги. не вдаючись до досвідченим даними, можна судити про глибину протікання хімічної реакції. Слід мати на увазі, що дані значень стандартних потенціалів не дозволяють визначити швидкість встановлення рівноваги реакції. За даними таблиць окисно-відновних потенціалів можливо знайти значення констант рівноваги приблизно для 85000 реакцій. Наведемо рекомендації ІЮПАК, якими слід керуватися, щоб правильно записати схеми гальванічних елементів і протікають в них реакції: Таким чином, при складанні схеми гальванічного елемента зліва записують електрод, на якому відбувається процес окислення (анод), а праворуч - електрод, на якому відбувається процес відновлення (катод). Наприклад, складемо схему гальванічного елемента. в якому здійснюється наступна реакція: В гальванічному елементі анодом є залізний електрод, а катодом - кадмієвий. Типові завдання з рішеннями ви знайдете тут.Як скласти схему гальванічного елемента?
Схожі статті