Осмотичний тиск (позначається π) - надлишковий гідростатичний тиск на розчин. відокремлений від чистого розчинника напівпроникною мембраною. при якому припиняється дифузія розчинника через мембрану (осмос). Це тиск прагне зрівняти концентрації обох розчинів внаслідок зустрічної дифузії молекул розчиненої речовини і розчинника.
Міра градієнта осмотичного тиску, тобто відмінності водного потенціалу двох розчинів, розділених напівпроникною мембраною, називається тонічності. Розчин, що має більш високий осмотичний тиск в порівнянні з іншим розчином, називається гіпертонічним, що має більш низьке - гіпотонічним.
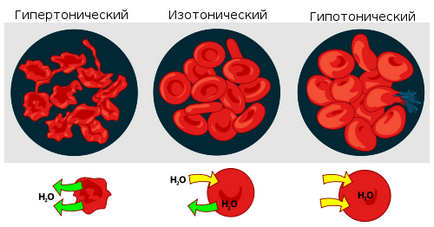
Взаємодія еритроцитів з розчинами в залежності від їх осмотичного тиску.
Якщо ж подібний розчин знаходиться в замкнутому просторі, наприклад, в клітці крові. то осмотичний тиск може призвести до розриву клітинної мембрани. Саме з цієї причини ліки. призначені для введення в кров, розчиняють у фізіологічному розчині. містить стільки хлориду натрію (кухонної солі), скільки потрібно, щоб врівноважити створюване клітинної рідиною осмотичнийтиск. Якби вводяться лікарські препарати були виготовлені на воді або дуже сильно розбавленому (гипотоническом по відношенню до цитоплазми) розчині, осмотичний тиск, змушуючи воду проникати в клітини крові, призводило б до їх розриву. Якщо ж ввести в кров дуже концентрований розчин хлориду натрію (3-10%, гіпертонічні розчини), то вода з клітин буде виходити назовні, і вони стиснуться. У разі рослинних клітин відбувається відрив протопласта від клітинної оболонки. що називається Плазмоліз. Зворотний же процес, що відбувається при приміщенні стиснулися клітин в більш розбавлений розчин, - відповідно, деплазмолізу.
Величина осмотичного тиску, створювана розчином, залежить від кількості, а не від хімічної природи розчинених в ньому речовин (або іонів. Якщо молекули речовини дисоціюють), отже, осмотичний тиск є колігативні властивості. Чим більше концентрація речовини в розчині. тим більше що створюється їм осмотичнийтиск. Це правило, що носить назву закону осмотичного тиску, виражається простою формулою, дуже схожою на якийсь закон ідеального газу:
Це показує також схожість властивостей частинок розчиненої речовини в в'язкому середовищі розчинника з частинками ідеального газу в повітрі. Правомірність цієї точки зору підтверджують досліди Ж. Б. Перрена (1906): розподіл частинок емульсії смоли гуммигута в товщі води в загальному підпорядковувалося законом Больцмана.
Осмотичний тиск, який залежить від змісту в розчині білків, називається онкотичним (0,03-0,04 атм). При тривалому голодуванні, хворобі нирок концентрація білків в крові зменшується, онкотичноготиск в крові знижується і виникають Онкотичний набряки. вода переходить з судин в тканині, де πОНК більше. При гнійних процесах πОНК у вогнищі запалення зростає в 2-3 рази, так як збільшується число часток через руйнування білків.
В організмі осмотичний тиск повинен бути постійним (близько 7,7 атм). Тому пацієнтам вводять ізотонічні розчини (розчини, осмотичний тиск яких дорівнює πплазми ≈ 7,7 атм. (0,9% NaCl - фізіологічний розчин, 5% розчин глюкози). Гіпертонічний розчини, у яких π більше, ніж πплазми. Застосовуються в медицині для очищення ран від гною (10% NaCl), для видалення алергічних набряків (10% CaCl2. 20% глюкоза), як послаблюючі ліків (Na2 SO4 ∙ 10H2 O. MgSO4 ∙ 7H2 O).
Закон осмотичного тиску можна використовувати для розрахунку молекулярної маси даної речовини (при відомих додаткових даних).
Обгрунтування формули Вант-Гоффа з термодинамічних позицій
У розчині вільна енергія G = G 0 + R T l n x A + π V C + RTlnx _ + \ pi V_>. де x A - молярна частина розчину, V C> - його молярний об'єм. Поява члена π V C> еквівалентно внесенню в вільну енергію зовнішнього тиску. Для чистого розчинника G = G 0>. При рівновазі ∇ G для розчинника дорівнює нулю. Таким чином,
0 = ∇ G = G 0 + R T l n x A + π V C - G 0 = R T l n x A + π V C. + RTlnx _ + \ pi V_-G ^ = RTlnx _ + \ pi V _,>
тобто отримана формула Я. Вант-Гоффа (π = c R T).
При її виведенні вирахувано, що x B> - мала величина. Це дозволяє розкласти l n (1 - x B))> в ряд і далі застосувати співвідношення x B ≅ n B n A. \ cong >>.> Твір n A V C> в розведених розчинах практично дорівнює обсягу розчину.
Осмотичний тиск колоїдних розчинів
Для виникнення осмотичного тиску повинні виконуватися дві умови:
- наявність напівпроникною перегородки (мембрани);
- наявність по обидва боки мембрани розчинів з різною концентрацією.
Мембрана прониклива для частинок (молекул) певного розміру, тому вона може, наприклад, вибірково пропускати крізь свої пори молекули води, не пропускаючи молекули етилового спирту. Для газової суміші - водню і азоту - роль напівпроникною мембрани може виконувати тонка паладієва фольга, крізь яку вільно дифундує водень, тоді як азот вона практично не пропускає. за допомогою такої мембрани можна розділяти суміш водню і азоту на окремі компоненти.
Простими і давно відомими прикладами мембран, які проникні для води і непроникні для багатьох інших розчинених у воді речовин, є шкіра, пергамент, і інші тканини тваринного і рослинного походження.
Пфеффер за допомогою осмометрі, в якому в якості напівпроникною мембрани використовувався пористий фарфор, оброблений C u 2 F e (C N) 6 Fe (CN) _>. досліджував осмотичнийтиск водних розчинів тростинного цукру. На основі цих вимірів Вант-Гофф в 1885 році запропонував емпіричне рівняння, якому підпорядковується осмотичнийтиск π розведених розчинів:
де c = n / V - концентрація розчиненої речовини, моль / м³.
Це рівняння за формою збігається з законом Бойля-Маріотта для ідеальних газів. Тому осмотичнийтиск розведених розчинів можна визначити як тиск, який би створювала ту ж саму кількість молекул розчиненої речовини, якби воно було у вигляді ідеального газу і займало при даній температурі об'єм, що дорівнює об'єму розчину.
Рівняння Вант-Гоффа можна кілька перетворити, підставляючи замість концентрації c i = n i / V = m i / M i V = n_ / V = m_ / M_V>:
де m i> - масова концентрація розчиненої речовини; M i> - його молекулярна маса.
У такому вигляді рівняння Вант-Гоффа широко застосовується для визначення молярної маси розчиненої речовини. Осмотический метод застосовують найчастіше для визначення молярних мас високомолекулярних сполук (білків, полісахаридів та інших). Для цього достатньо виміряти осмотичний тиск розчину з відомою концентрацією.
Якщо речовина дисоціює в цьому розчині, то осмотичний тиск буде більшим ніж розраховане і потрібно вводити ізотонічний коефіцієнт:
Рівняння Вант-Гоффа справедливо тільки для розведених розчинів, які підкоряються закону Рауля. При підвищених концентраціях розчинів c i> в останньому рівнянні має бути замінено на активність a 1> або фугітівность f 1..>
Роль осмосу в біологічних системах
Явище осмосу і осмотичний тиск відіграють велике значення в біологічних системах, які містять напівпроникні перегородки у вигляді різних тканин, в тому числі оболонок клітин. Постійний осмос води всередину клітин створює надлишковий гідростатичний тиск, який забезпечує міцність і еластичність тканин, яке називають тургором.
Якщо клітку, наприклад, еритроцит, помістити в дистильовану воду (або дуже розбавлений розчин солі), то вода буде проникати всередину клітини і клітина буде набухати. Процес набухання може привести до розриву оболонки еритроцита, якщо станеться так званий гемоліз.
Процеси засвоєння їжі, обміну речовин тісно пов'язані з різною проникністю тканин для води та інших розчинених в ній речовин.
Осмотичний тиск відіграє роль механізму, який подає нутрієнти клітинам; у високих дерев останні піднімаються на висоту декількох десятків метрів, що відповідає осмотичного тиску в кілька десятків атмосфер. Типові клітини, що сформувалися з протоплазматических мішків, наповнених водними розчинами різних речовин (клітинний сік), мають певне значення для тиску, величина якого вимірюється в межах 0,4-2 МПа.