СЛ. 10 (0) величина 1 / r. зворотна питомому опору, яка називається питомою електропровідністю. Позначається вона літерою c (грец. «Каппа»), З урахуванням цього позначення рівняння (***) набуде вигляду:
(1) Якщо S = 1 см 2. аl- 1 см, тоL, = c. Питома електропровідність електроліту c являє собою величину, зворотну опору стовпа розчину довжиною в 1 см і площею перетину в 1 см 2. Вимірюється питома електропровідність в [Ом -1 * см -1].
Оскільки в розчинах електролітів при проходженні електрич-пра іони переміщаються між електродами і віддають свій заряд тільки на їх поверхні, то в наведеній формулі S позначає площа, l - відстань між електродами.
(2) Наприклад, питомий опір зразка води при 18 ° С дорівнює r = 2 * 10 6 ом • см. Питома електропровідність цього зразка води буде дорівнює:
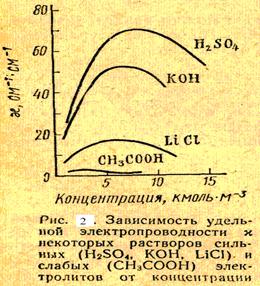
Якщо ми опустимо в цю воду два електроди площею в 1 см 2, то при відстані між електродами в 1 см і різниці потенціалів в 1 в сила струму дорівнюватиме 5 • 10 -7 а (при 18 ° С). Електропровідність розчинів електролітів залежить від загального числа їх іонів в одиниці об'єму розчину. Внаслідок цього питома електропровідність елек-тролітов залежить від концентрації розчину. У міру збільшення кон-центрації електроліту питома електропровідність спочатку зростає, а потім зменшується, так як разом з ростом числа іонів зменшується ско-кість їх переміщення, а також сте-пень дисоціації речовини. Перший фактор діє в розчинах сильних електролітів, другий - в розчинах сла-Бих електролітів. При досягненні оп-ределенной концентрації розчину вплив перерахованих факторів ста-новится настільки значним, що подальше збільшення концентрації призводить до зменшення електропровід-ності (рис. 2СЛ. 11).
Питома електропровідність ра-створів електролітів залежить також від індивідуальних властивостей іонів. Де-ло в тому, що кількість стерпного іонами електричного струму в розчині електроліту залежить не тільки від числа іонів в одиниці об'єму, але і від скоро-сті їх руху.
Відомо, що різні іони рухаються в електричному полі з неоднаковою швидкістю. У табл. 1 СЛ. 12 наведені значення швидкості руху деяких іонів, віднесені до падіння потенціалу в 1 в / см (абсолютні швидкості руху іонів).
Абсолютні швидкості іонів (див * сек) в воді при 18 ° С і різниці потенціалів 1 в / см
Як видно з табл. 1 швидкості руху іонів при проходженні електричного струму в загальному дуже малі в порівнянні зі швидкостями руху молекул в газах. Так, іон водню у водному середовищі рухається приблизно в сто мільйонів разів повільніше, ніж молекула Н2 в газоподібному середовищі. Пояснюється це тим, що іони у воді гідратованих і при русі відчувають величезний опір з боку середовища (розчинника). З даних табл. 1 видно, що іони Н + і ОН - мають порівняно з усіма іншими іонами найбільшими абсолютними швидкостями, що не можна пояснити тільки малим заради-вусом іонів Н + і ОН -. Радіус ОН - -іона (1,40А °) можна порівняти з радіусами інших іонів, іон Н + у водних розчинах існує лише у вигляді іона гідроксонію Н 3 О +. радіус якого також можна порівняти з радіусами мно-гих іонів.
Електропровідність розчинів залежить також і від заряду іонів: чим він вищий, тим більше кіль-кість електрики переносить іон з одного електрода на інший. Так, кожен двозарядний аніон віддає анода два електрона, а одне-зарядний - тільки один.
Питома електропровідність розчинів залежить також від темпе-ратури. Ця залежність досить складна. При підвищенні темпе-ратури швидкість руху іонів зростає в зв'язку зі зменшенням в'язкості середовища. Крім того, изме-ня температури впливає на ступінь електролітичноїдисоціації електроліту і тим самим на електропровідність розчину. Вище-ня температури на 1 ° С веде до прискорення руху іонів, а следо-вательно, до зростання електропровідності розчину на 1,5-2,7%.
Оскільки питома електропровідність залежить від багатьох фак-торів, на основі її вивчення неможливо возможним- зробити будь-яких висновків загального характеру. Тому для зручності обліку впливу на електропровідність розчинів електролітів їх концентрації-ції і взаємодії між іонами Ленцем було введено поняття про еквівалентної електропровідності.
Генерація сторінки за: 0.003 сек.