Познайомимося тепер коротко з пристроєм молекул, т. Е. Частинок, в яких об'єднано кілька атомів. В основному існують два способи утворення молекул з атомів.
Перший з цих способів заснований на виникненні з нейтрального атома електрично зарядженої частинки. Ми вже зазначали вище, що атом є нейтральним, т. Е. Число позитивних зарядів в його ядрі (число протонів) врівноважується числом негативних зарядів, т. Е. Числом що обертаються навколо ядра електронів.
Якщо з яких-небудь причин атом втрачає один або кілька електронів, то в його ядрі виявляється деякий надлишок позитивних зарядів, що не врівноважених негативно зарядженими електронами, і такий атом стає позитивно зарядженою часткою.
Такі електрично заряджені частинки називаються іонами. Вони і сприяють утворенню молекул з атомів.
Вивчення властивостей різних хімічних елементів показує, що у всіх випадках є найбільш стійкими ті з них, у яких зовнішня електронна орбіта заповнена повністю, або містить найбільш стійке число електронів - 8.
Це блискуче підтверджує таблиця Менделєєва, де в нульової групи розташовані найбільш інертні (т. Е. Стійкі і не вступають в хімічні реакції з іншими речовинами) елементи.
Це, по-перше, гелій, який має одну орбіту, заповнену двома електронами, і гази неон, аргон, криптон, ксенон і радон, які мають у зовнішній орбіті вісім електронів.
Навпаки, якщо зовнішня орбіта атомів має всього лише один-два електрона, то такі атоми мають схильність віддавати ці електрони інших атомів, у яких у зовнішній орбіті не вистачає 1-2 електрона до числа вісім. Такі атоми є найбільш активними до взаємодії один з одним.
Візьмемо для прикладу молекулу кухонної солі. званої в хімії хлористим натрієм і освіченою, як показує її назву, з атомів натрію і хлору. У атома натрію на зовнішній орбіті є один електрон, а у атома хлору - сім електронів.
Якщо ці два атома наблизяться один до одного, то один електрон натрію, що знаходиться на зовнішній орбіті і слабо «прив'язаний» до свого атому, може відірватися від нього і перейти до атома хлору, у якого в зовнішній орбіті він буде восьмим електроном (рис. 4 , а).
В результаті такого переходу утворюються два іона: позитивний іон натрію і негативний іон хлору (рис. 4, б), що притягуються один до одного і утворюють молекулу хлористого натрію, яку можна уявити, як дві кульки, стягнуті пружиною (рис. 4, в) .
Другий спосіб утворення молекул з атомів полягає в тому, що при зближенні двох або більше атомів знаходяться у цих атомів у зовнішніх орбітах електрони перебудовуються таким чином, що стають пов'язаними з двома або кількома атомами. Електрони ж, що знаходяться на внутрішніх орбітах, продовжують залишатися пов'язаними тільки з даним атомом.
При цьому знову-таки є прагнення утворювати найбільш стійкі орбіти з восьми електронів.
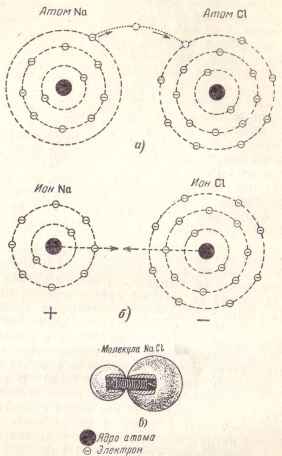
Мал. 4. Схема утворення молекули хлористого натрію.
Наведемо кілька прикладів таких молекул.
Візьмемо молекулу вуглекислого газу, що складається з атома вуглецю і двох атомів кисню. При утворенні цієї молекули відбувається наступне перестроювання електронів зовнішніх орбіт цих атомів (рис 5)
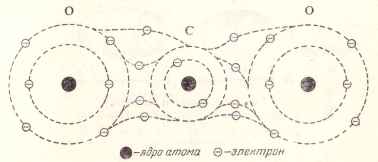
Мал. 5. Схема молекули вуглекислого газу.
Атом вуглецю залишає пов'язаним зі своїм ядром два електрона на внутрішній орбіті, а чотири електрона, що знаходяться на його зовнішній орбіті, розподіляються по два електрона на кожен атом кисню, які в свою чергу віддають кожен по два електрона для загальної зв'язку атома вуглецю.
Таким чином, в кожному зв'язку вуглець-кисень беруть участь взаємно дві пари електронів, в результаті чого кожен з трьох атомів такої молекули має стійку зовнішню орбіту, по якій обертаються вісім електронів.
Є, як відомо, молекули, не тільки освічені з різних елементів, але і з однакових атомів.
Утворення таких молекул також пояснюється прагненням до найбільш стійкого восьмерню числу електронів в зовнішньому орбіті.
Так, наприклад, атому кисню, що має два електрона у внутрішній орбіті і шість електронів у зовнішній орбіті, не вистачає двох електронів для утворення восьмерню оточення.
Тому ці атоми з'єднуються по два, утворюючи молекулу кисню О2. в якій по два електрона від кожного атома узагальнюються, після чого навколо них у зовнішній орбіті буде обертатися по вісім електронів.
При утворенні молекул за другим способом, коли відбувається обмін електронами між атомами, центрам атомів потрібно зблизитися більш, ніж за першим способом, коли відбувається тільки взаємне притягання протилежно заряджених іонів.
Тому, якщо в першому способі можна собі уявити таку молекулу у вигляді двох дотичних куль-іонів (рис. 4, в), які не змінюють свої розміри і форму, то при другому способі кулясті атоми як би сплющуються.
Сучасні методи дослідження будови речовин дозволяють не тільки знати, з яких атомів складаються різні молекули, але також як розташовуються атоми в молекулах, т. Е. Структуру цих молекул аж до відстаней між ядрами атомів, що входять до складу молекул.
На рис. 6 показані структури молекул кисню і вуглекислого газу, а також розташування ядер атомів в цих молекулах із зазначенням меж'ядерних відстаней в ангстремах.
Молекула кисню, що складається з двох атомів, має форму двох спресованих куль з відстанню між ядрами атомів 1,20А. Молекула вуглекислого газу, що складається з трьох атомів, має прямолінійну форму з атомом вуглецю в середині і розташованих по обидві сторони від нього по прямій лінії двох атомів кисню з меж'ядерних відстанями 1,15 А.
Мал. 6. Структури молекул: а - розташування атомів; б - розташування ядер атомів; 1 - молекула кисню О2; 2 - молекула вуглекислого газу СО2.