Осмос має велике значення в життєдіяльності людини, тварин і рослинних організмів. Як відомо, всі біологічні тканини складаються з клітин, всередині яких знаходиться рідина (цитоплазма), що представляє собою розчин різних речовин в Н2 О. Оболонка клітини напівпроникності і через неї досить вільно проходить вода.
Іони електролітів і молекули інших речовин оболонка пропускає строго вибірково.
Зовні клітини омиваються міжклітинної рідиною, теж представляє собою водний розчин. Причому концентрація розчинених речовин усередині клітин більше ніж в міжклітинної рідини. Внаслідок осмосу спостерігається перехід розчинника із зовнішнього середовища в клітку, що викликає її часткове набухання або тургор. При цьому клітина набуває відповідну пружність і еластичність. Тургор сприяє збереженню певної форми органів у тварин організмів, стебел і листя у рослин. У зрізаних рослинах в результаті випаровування води об'єм між- і внутрішньоклітинної рідини зменшується, знижується осмотичний тиск, пружність клітин знижується і рослина в'яне. Зволоження рослин, переміщення їх в воду викликає осмос і знову повідомляє тканинам пружність.
Кров, лімфа, тканинні рідини людини є водні розчини молекул і іонів багатьох речовин і мають внаслідок цього певним осмотичним тиском. Причому протягом усього життя організму біологічні рідини зберігають свій тиск на постійному рівні незалежно від стану зовнішнього середовища. Це явище називається іначеізоосміей людського організмаі є складовою частиною більш загального процесу -гомеостазаілі сталості ряду фізико-хімічних показників внутрішнього середовища людини в мінливих зовнішніх умовах.
Ізоосмія особливо властива таким біологічних рідинах як кров і лімфа. Так осмотичний тиск крові у людини завжди і при 37оС змінюється в межах 740-780 кПа (тобто майже в 8 разів більше атмосферного).
Осмотичний тиск крові у різних живих організмів неоднаково. Так у жаб воно нижче, ніж у людини, а у деяких морських тварин, навпаки, більше.
Ізоосмія регулюється, перш за все, центральною нервовою системою і діяльністю залоз внутрішньої секреції.
Відхилення тиску крові від норми викликає хворобливий стан. Так при його зниженні спостерігається блювота, судоми, затемнення свідомості. Підвищення осмотичного тиску супроводжується набряком, порушенням серцевої діяльності.
У деяких випадках зміна осмотичного тиску в обмежених ділянках тканин можуть бути досить великими. Так при локальних запальних процесах білкові молекули в клітинах розпадаються на масу дрібніших фрагментів, збільшуючи тим самим число розчинених частинок в них. Вода з навколишніх тканин і судин спрямовується в ці клітини і значно збільшує їх обсяг. При цьому в районі запального вогнища виникає пухлина. При її розрізі або проколі гнійна рідина витікає з неї під великим тиском.
Розчини, осмотичний тиск яких дорівнює осмотичного тиску розчину прийнятого за стандарт, називаютсяізотоніческімі. У медицині осмотичнийтиск розчинів порівнюють з осмотичним тиском крові. Ізотонічними по відношенню до крові є 0,9% (0,15 М) растворNaClі 4,5-5% розчин глюкози. У цих розчинах концентрація частинок розчиненої речовини така ж, як і в плазмі крові. Відмінність полягає лише в тому, що до складу крові входить не толькоNaClілі глюкоза, але і цілий ряд інших речовин. Їх сумарна концентрація носить названіеосмолярності (изотонической концентрації) і являє собою хімічну кількість всіх кінетично активних (тобто здатних до самостійного руху) частинок (незалежно від їх форми, розмірів і природи), що містяться в 1 літрі плазми крові.
Осмолярність концентрація крові у людини становить 0,287-0,303 моль / л.
Ізотонічні розчини NaClі глюкози називають частофізіологіческімі розчинами. Хоча в даний час цей термін для них визнаний невдалим, тому що строго кажучи, істинним фізіологічним розчином є розчин за своїм кількісним і якісним складом максимально наближений до плазми крові.
Розчини, що володіють більш високим осмотичним тиском, ніж плазма крові, називаютсягіпертоніческімі, а розчини, що мають більш низький тиск -гіпотоніческімі.
При різних лікувальних процедурах в кров людини в великих кількостях слід вводити тільки ізотонічні розчини, щоб не викликати осмотичний конфлікт через різке невідповідності між осмотичним тиском біологічної рідини і введеного розчину.
При контакті клітини з гіпертонічним розчином відбувається відтік води з клітини через мембрану в навколишнє середовище. Клітка при цьому втрачає свою пружність, внаслідок зневоднення і зменшується в обсязі (зморщується). Нормальний перебіг фізичних і хімічних процесів в ній порушується (рис. 25).
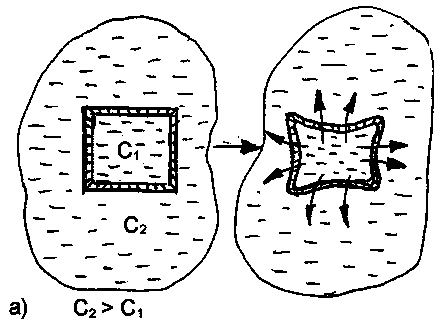
Мал. 25. Схематичне зображення процесів плазмолізу (а) і лізису (б), що протікають в результаті приміщення клітини, відповідно, в гіпертонічний або гіпотонічний розчини.
Дане явище називається Плазмоліз іліекзосмосом.
Плазмоліз в більшості випадків є оборотним процесом. Плазмолізірованние клітини, поміщені в ізотонічний розчин, знову набухають, відновлюючи свою життєдіяльність. Але при занадто сильному і тривалому зневодненні клітина може втратити свою життєздатність.
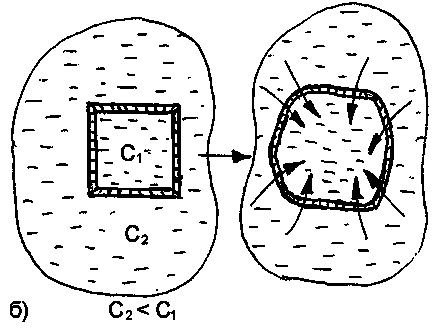
При контакті з гіпотонічним розчином вода із зовнішнього середовища переходить всередину клітини. В результаті цього збільшується, і може статися розрив її оболонки. Дане явище називаетсялізісоміліендосмосом (рис. 25).
Якщо в якості клітинної культури використовувати еритроцити, то внаслідок розриву їх оболонок зовнішнє середовище забарвиться гемоглобіном в червоний колір. В цьому випадку дане явище називають інакше гемолизом (іліерітроцітолізом).
Гемоліз є окремим випадком більш загального явища -цітоліза (руйнування тваринних і рослинних клітин під впливом різних причин).
У крові руйнування оболонки у всіх еритроцитів настає якщо її осмотичний тиск знижується до 260-300 кПа. Колір крові при цьому частково змінюється і приймає характерний, «лаковий» відтінок.
У клінічній практиці в деяких випадках можуть застосовуватися не тільки изотонические, але і гіпертонічні розчини. Наприклад, в хірургії використовують марлеві смужки, змочені в гіпертонічному розчині NaClдля накладення на гнійні рани. При цьому внаслідок осмосу ток рідини направляється по марлі назовні з рани, що сприяє постійному очищенню рани від гною, мікроорганізмів, продуктів розпаду і т.д. (Рис. 26).
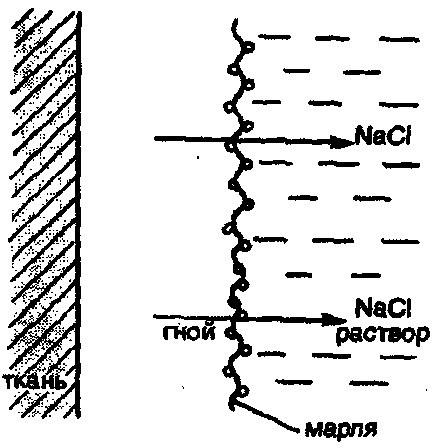
Мал. 26. Принцип застосування гіпертонічних пов'язок для очищення уражених тканин від гною і продуктів розпаду
Гіпертонічні розчини вводять внутрішньовенно при глаукомі, щоб знизити внутрішньоочний тиск через підвищеного вмісту рідини в передній камері ока.
Явищем осмосу пояснюють проносну дію глауберовой (Na2 SO4 · 10H2 O) і гіркого (MgSO4 · 7H2 O) солей.
Ці солі погано всмоктуються в кров і тому їх висока концентрація в кишечнику викликає інтенсивний перехід води всередину нього з навколишніх тканин, сприяючи послаблювальну дію.
Багато бактеріальні клітини мають високий осмотичний тиск. При дії антибіотиків (наприклад, пеніциліну) відзначено зниження процес біосинтезу стінок зростаючих стрептококів. Вони стають неміцними і під дією внутрішнього осмотичного тиску легко руйнуються.
Таким чином, розуміння і контроль осмотических процесів, а також вміння надавати на їх перебіг той чи інший вплив має вкрай важливе значення в біології та медицині.