Які сили дійсно утримують в молекулі атоми один біля одного, якщо для розпаду молекули на нейтральні атоми треба нагріти газ приблизно до 4000 К? З якими основними проблемами ми стикаємося при спробі знайти відповідь на це питання, яке хвилює хіміків усього світу і до цього дня?
Розглянемо ці проблеми більш детально. На підставі сформульованих нами уявлень про будову атома може бути запропонована виключно проста модель молекули водню - два протона (по одному в кожному ядрі) і два електрона (рис. 1).
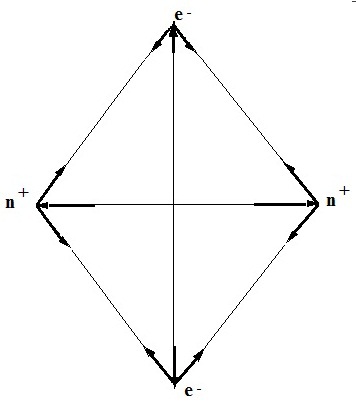
Рис 1. Проста модель молекули водню
Відповідно до цієї моделі позитивно заряджені ядра притягують до себе електрони, що знаходяться в полі дії обох ядер. Одночасно діють і сили відштовхування між однойменно зарядженими частинками. З експериментів відомо, що при утворенні будь-якого зв'язку відбувається виділення енергії. Таким чином, якщо зв'язок утворилася, то, отже, сили тяжіння в молекулі повинні превалювати над силами відштовхування.
Однак розрахунки, виконані на основі експериментального визначення таких параметрів, як потенціал іонізації, спорідненість до електрону (енергія, що виділяється при приєднанні електрона до нейтрального атома), довжина зв'язку (відстань між центрами взаємодіючих атомів), знаходяться в явному протиріччі з цієї простою схемою. Оскільки спорідненість атома водню до електрону (СЕ) одно 72 кДж / моль, то енергія подолання сил тяжіння електронів ядрами не повинна перевищувати 2СЕ, тобто 144 кДж / моль. Однак для того щоб зруйнувати молекулу водню, потрібно затратити енергію рівну 432 кДж / моль. Ці розбіжності між розрахунком і експериментом в дійсності будуть ще більше, якщо врахувати сили відштовхування між ядрами.
З експериментів по вимірюванню ковалентного радіуса відомо, що відстань між двома ядрами в молекулі водню одно 0,068 нм. З урахуванням цієї відстані сили відштовхування ядер (кулонівської взаємодії) становила 1877 кДж / моль. При утворенні молекули водню необхідно подолати ці сили відштовхування. Відповідно до теореми вириала, енергія, необхідна для руйнування молекули водню, повинна дорівнювати половині потенційної енергії, тобто 1877: 2 ≈ 939 кДж / моль. Таким чином, при утворенні молекули водню виграш в енергії складе 939 + 432 = одна тисяча триста сімдесят одна кДж / моль, тоді як з моделі (див. Рис.1) слід, що максимальний виграш енергії дорівнює 144 кДж / моль, що становить всього 10,5% від експериментально знайденого. Таким чином, можна зробити висновок, що за цією моделлю хімічний зв'язок в молекулі водню не може утворитися. Ми знову не отримали відповіді на питання: Які ж сили утримують атоми в молекулі?
Серйозні протиріччя виникають, при спробі знайти відповідь на наступне питання: Яким чином енергія, відповідна розриву зв'язку, передається молекулі?
Як уже зазначалося, для розриву хімічного зв'язку потрібно повідомити енергію системі. Якщо припустити, що енергія зв'язку порівнянна з енергією електронів, то слід очікувати зміни їх енергії, як при виникненні молекули, так і при її руйнуванні. Навіть таке просте пояснення знаходиться в протиріччі з експериментальними даними.
Експериментально знайдена енергія зв'язку в молекулі водню дорівнює 432 кДж / моль. Отже, при розриві зв'язку, тобто при витраті такої кількості енергії, енергія електронів в атомах повинна збільшитися на 432 кДж / моль. Однак відповідно до спектральними даними атомів, електрони можуть поглинати порцію енергії тільки більше 1000 кДж / моль (
166. 10 -23 кДж / електрон). Крім того, деякі експериментальні факти не тільки не отримують пояснення в рамках електростатичного моделі, але і знаходяться з нею в явному протиріччі. Наприклад, хімічний зв'язок, як правило, утворюється за участю двох електронів. Якщо електрони дійсно об'єднуються, то чому завжди м2 (не 1 і не 3)? Далі, все електростатичні характеристики атомів (ППІ, електронний торгівельний, спорідненість до електрону) зростають по періоду зліва направо (тобто від першої групи Періодичної системи елементів), тоді як залежність енергії зв'язку М-М (де М - будь-який елемент) від першого потенціалу іонізації, знайдена експериментально, в тому ж напрямку проходить через максимум. Причому максимальне значення вершини параболи, як правило, припадає на середину періоду. У той же час довжина зв'язку з періоду зменшується.
Питання про природу хімічного зв'язку залишається відкритим не тільки з позицій хімії, а й з точки зору фізики, як і питання про наявність якоїсь третьої сили.