При розчиненні в воді комплексні сполуки зазвичай розпадаються так, що внутрішня сфера поводиться як єдине ціле:
K [Ag (CN) 2] K + + [Ag (CN) 2] -
Поряд з цим процесом хоч і поза значній мірі, проиходит дисоціація внутрішньої сфери комплексу: [Ag (CN) 2] - Ag + + 2CN -
Застосувавши до останнього рівноваги вираз константи іонізації, отримаємо співвідношення, зване константою нестійкість комплексу:
Константа нестійкості є міра міцності комплексу. Замість константи нестійкості іноді користуються зворотною величиною, званої константою стійкості:
У ряду сполук, які розглядаються як комплексні, константи нестійкості настільки великі, що концентрації складових частинок виявляються більше концентрації комплексного іона. До таких сполук відносяться подвійні солі, які в твердому стані мають координаційну структуру, а в розчині в значній мірі розпадаються на складові іони, наприклад:
K2 [CuCl4] 2K + + [CuCl4] 2 2K + + Cu 2+ + 4Cl -
У помірно розведених розчинах цієї солі існують як комплексні, так і прості іони. Подальше розведення призводить до повного розпаду комплексних іонів [CuCl4] 2.
Хелати. хелатний ефект
До дуже важливим циклічним з'єднанням відносять так звані хелати або клешнеобразние з'єднання, в яких центральний атом і полідентантний ліганд утворюють цикл. Наприклад, при взаємодії гідроксиду міді з аминоуксусной кислотою утворюється нейтральний комплекс:
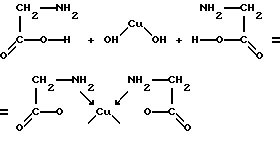
Кожна молекула аминоуксусной кислоти використовує обидві функціональні групи. В одному випадку вона з'єднується з центральним атомом через дві аміногрупи по донорно-акцепторного механізму, а в другому - через кисень карбоксильної групи звичайної ковалентного зв'язком. Комплексоутворювач при цьому виявляється як би втягнутим всередину лиганда, охоплений зв'язками зразок клешні рака. Звідси і походить назва хелат. Прикладами інших хелатів можуть служити комплекси з етилендіаміном NH2-C2H4-NH2, етилендіамінтетраоцтової кислотою (ЕДТА), щавлевої кислотою.
До ХЕЛАТ також відносяться такі важливі для життя сполуки, як хлорофіл і гемоглобін:
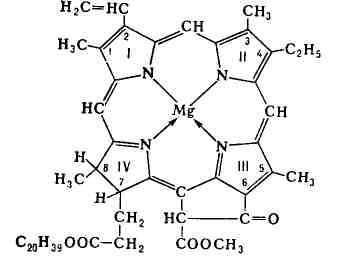
Комплексоутворювачем в хлорофілі виступає магній, а в гемоглобіні - залізо. В одній площині з металом розташовуються чотири атома азоту органічного ліганду. По інший бік від площини залізо приєднуємо молекулу білка (глобіну), а по іншу молекулу кисню. Такий продукт називається оксигемоглобіном. Він утворюється в легенях, де гемоглобін приєднує кисень повітря і далі у вигляді оксігемоглобані розноситься по всьому організму. Хлорофіл відіграє найважливішу роль в процесах фотосинтезу, що протікають у всіх зелених рослинах.
Наявність в ХЕЛАТ циклічних угрупувань сильно збільшує їх стійкість в порівнянні з сполуками подібного складу, але не мають циклів. Таке підвищення стійкості називають хелатним ефектом. Цей термін був введений Г.Шварценбахом в 1952 році для пояснення експериментально виявленого факту істотно більш високу стійкість комплексів іонів металів з полідентатними реагентами в порівнянні з комплексами цих же металів з монодентатно лигандами. Хелатний ефект (ХЕ) кількісно виражається наступним співвідношенням:
де Z - m-дентатність ліганд, а lg # 946; MAm = lgKMA1 + lgKMA2 + ... + lgKMAn
Хелатний ефект - це різниця між логарифмами константи стійкості хелатного комплексу та загальної константою стійкості комплексу, утвореного цим же іоном металу з відповідним монофункціональним лигандом.
Г.Шварценбах запропонував так зване ентропійне тлумачення хелатного ефекту. Із загальних фізико-хімічних міркувань
# 916; Go = -RTlnK = # 916; Ho - T # 916; So.
Шварценбах вважав, що висока стійкість хелатів з полідентатними лигандами пов'язана зі збільшенням ентропії вкладу в вільну енергію утворення комплексу. Для комплексів з монодентатно лигандами реакцію освіти можна записати в такий спосіб:
тоді як для полідентатних лигандов процес піде трохи інакше:
Відповідно до цих рівняннями при комплексообразовании з монодентатно лигандами загальне число вільно вагається частинок в розчині не змінюється, а в разі полідентатних - збільшується, що призводить до збільшення ентропії системи.