Технологія переробки нафти і газу. Частина 1
Реакції ізомеризації парафінових вуглеводнів є равновес-ними:
Вони протікають практично без зміни обсягу, тому термодіна-мическое рівновагу залежить тільки від температури; низькі температури бла-гопріятствуют утворення ізопарафінових вуглеводнів. Тепловий ефект реакції ізомеризації невеликий - від 2 до 20 кДж / моль - і мало змінюється з изме-ням температури. Дослідженню рівноваг реакцій ізомеризації пара-фінів вуглеводнів присвячено значну кількість робіт експери-ного і розрахункового характеру. Спостережуване для деяких вуглеводнів НЕ-збіг пояснюється недостатньо точним обчисленням термодинамич-ських величин. При розрахунку рівноважних складів за значеннями констант рав-новесія необхідно також враховувати, що на практиці при протіканні реакції ізомеризації не завжди утворюються всі теоретично можливі ізомери; на-приклад, в продуктах ізомеризації Понтано були виявлені тільки два з-мера - н-пентан і ізопентан (2-метилбутан); неопентана (2,2-діметілпропан) ні виявлено. Останнє викликано нестабільністю первинного карбкатиона - необхідної стадії перегрупування вторинного карбкатиона. З огляду на відсутність про-наслідком неопентана рівновагу повинно розглядатися тільки між н-пентаном і з-пентаном. Те ж саме відноситься до ізомерів гептана: при про-веденні ізомеризації відсутні 2,2-діметілпентан, 3,3-діметілпентан, З-етил пентан, що пов'язано з труднощами кінетичного характеру.
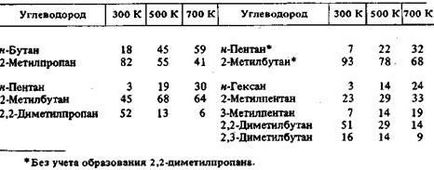
Константи рівноваги реакцій ізомеризації парафінів C4-С6, енталь-Пія ізомеризації і зміна ентропії ізомеризації, обчислені на осно-вання спектроскопических даних і даних про вільні енергіях, наведені в табл. 5.8, а рівноважні склади сумішей ізомерів - в табл. 5.9. При розрахунках констант рівноваги реакції ізомеризації використовується різниця в вільних енергіях ізомерів:
Дж / (моль К), і, константи рівноваги Кр для реакції ізомеризації парафінових вуглеводнів С4-С6 в газовій фазі
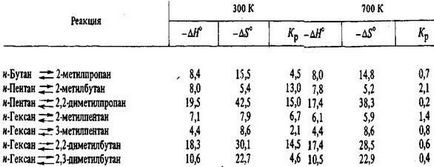
Склад рівноважної суміші розраховується на підставі констант рівноваги ізомеризації кожного вуглеводню в інший:
Таблиця 5.9 Масовий склад (у%) рівноважних сумішей ізомерів парафінів С4-С6
Кінетика і механізм реакції ізомеризації залежать від типу каталізатора та умов проведення реакції. В умовах гетерогенного каталізу реакція ізомеризації парафінів протікає по термодинамічно контрольованого механізму. Кількісною оцінкою кінетичних параметрів реакційної здатності вуглеводнів є константа швидкості перетворення углево-огрядний в ізомерний вуглеводень або суміш ізомерів. Вивчення шляхів цих перетворень і складу проміжних продуктів пов'язано з вивченням меха-нізму реакції.
При здійсненні ізомеризації парафінових вуглеводнів на про-промислових алюмоплатінових каталізаторах, промотованих фтором і хлором, металцеолітного каталізаторах, а також сверхкіслотах, особливості кінетики і механізму реакції обумовлені механізмом освіти проме-жуточних з'єднань.
Запропоновано кілька механізмів утворення карбкатиона, один з них зводиться до міжмолекулярної гідридний переносу:
Існує інша точка зору, згідно з якою карбкатион можуть утворюватися з парафінів шляхом відщеплення гідрид-іона Льюісовского ки-слоти:
В цьому випадку шляхом рекомбінації протона і гідрид-іона може образо-тися газоподібний водень.
Ізомеризація парафінових вуглеводнів в сверхкісдотних середовищах відбувається шляхом протонування парафинового вуглеводнів по s-зв'язку, при цьому утворюється некласичний карбонієвого іон з двухелектронной трехцен-тров зв'язком, подальше розщеплення якого призводить до утворення звичайного трехкоордінірованного карбкатиона і водню:
Механізм ізомеризації на біфункціональних каталізаторах. Розглядають-рівая механізм реакції ізомеризації парафінових вуглеводнів на Бі-функціональних каталізаторах, содержадіх метали VIII групи, можна припустити три типові випадки, в залежності від кислотності носія:
на каталізаторах з дуже сильною кислотністю носія ізомеризується-ція відбувається на кислотних центрах, роль металу зводиться до ограни-ню освіти коксу і запобіганню від дезактивації кислотних центрів; прикладом може служити процес на алюмоплатіновом катали-заторі, промотувати хлором;
на каталізаторах з дуже низькою кислотністю носія ізомеризація відбувається тільки на металевих центрах, і механізм реакції зави-сит від розміру кристалітів металу;
на каталізаторах із середньою кислотністю носія, таких як плати-на на аморфному алюмосиликате або на фторованими оксиді алюмінію, ізомеризація відбувається за звичайним біфункціонального механізму -освіту проміжних з'єднань на металевих ділянках ії-зомерізація олефінів на кислотних ділянках.
Якщо ізомеризація протікає на поверхні металів, механізм отли-чає від біфункціонального. У разі біфункціонального механізму в ад-сорбції парафинового вуглеводнів на поверхні металу беруть участь два сусідніх атома вуглецю, від парафинового вуглеводнів можуть отщепляться два атома водню з утворенням олефина в газовій фазі, адсорбований олефин може піддатися гідрогенолізу. Якщо парафін адсорбується ато-мами вуглецю, які не є сусідніми, то можливі освіту но-вої С-С-зв'язку, що приводить до п'яти-або шестичленних циклічних вуглеводнів, і їх подальше розкриття за рахунок розриву інший С-С-зв'язку. Для протікання такої реакції необхідно, щоб пов'язані з поверхнею атоми вуглецю були розділені на чотири чи п'ять атомами вуглецю і пов'язані з двома сусідніми атомами металу. Можливість протікання такої реакції була відкрита Го і Андерсеном. Послідовність реакцій при такому меха-низме ізомеризації наступна:
дві несуміжні С-Н-зв'язку розриваються, а вуглеводень адсорбується на поверхні атомами вуглецю, пов'язаними з сусідніми центрами ме-Таллах;
зв'язок С-С утворюється між двома адсорбованими атомами вугле- роду, що призводить до утворення циклопентанового або циклогексан-вого кільця, які можуть десорбувати;
циклічні частки можуть повторно адсорбироваться на поверхні або змушують атоми вуглецю, які пов'язані з поверхнею, на дру-Гії без десорбції, а С-С-зв'язок може розірватися;
4) приєднання атома водню до адсорбованим частинкам і десорбція без освіти З-С-зв'язку призводять до скелетної ізомеризації н-гексану в 2-метилпентан.
На рис. 5.16 показана схема ізомеризації для парафінових вуглеводнів С6 на поверхні металу.
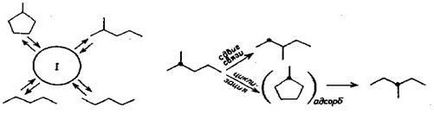
Ріс.5.16 Схема реакції ізомеризації гексану на поверхні металу: I - пя-
тітічленное кільце на поверхні.
Мал. 5.17 Зрушення зв'язку і циклічна ізомеризація 2-метіллентана - 2-13C. ви-сказані міркування про комбінуванні біфункціонального і кислотного ме-ханізм на платіноморденітсодержащем каталізаторі.
Другим механізмом ізомеризації парафінів на металах є механізм зсуву зв'язку. Він передбачає утворення а-, a-, g -тріадсорбірованних з'єднань, пов'язаних з двома сусідніми атомами металу. Ізомеризація НЕ-опентана повинна включати адсорбцію на двох атомах металу, освіта зв'язку між атомами вуглецю на поверхні і розрив однієї з зв'язків в ко-роткожівущем ціклопропановом кільці з утворенням 2-метилбутан.
Вивчення реакції ізомеризації гексанов за допомогою мічених атомів 13С дозволило визначити співвідношення механізмів реакції зсуву зв'язку та циклічної ізомеризації в залежності від властивостей каталізатора. Оцінка розмірів кристалітів платини в каталізаторі показала, що в разі кристаллитов розміром менше 2 нм переважають циклічна ізомеризація і неселек-тивний гидрогенолиз метілціклопентана, в той час як на більших кристаллитами переважають зрушення зв'язку і селективний гидрогенолиз.
Відносна сила металевих і кислотних центрів визначає чи-мітірующую стадію реакції.