Взаємодія між молекулами. комплексні сполуки
У попередньому розділі було розглянуто взаємодію атомів з утворенням молекул, а також представлені структури і деякі властивості молекул. Справжня глава присвячена взаємодії молекул.
При зближенні молекул з'являється тяжіння, що обумовлює значну-кість виникнення конденсованого стану речовини. До основ-ним видам взаємодії молекул слід віднести вандерваальсови сили, водневі зв'язки і донорно-акцепторна взаємодія.
У 1873 р голландський вчений І. Ван-дер-Ваальса припустив, що існують сили, що зумовлюють тяжіння між молекулами-лами. Ці сили пізніше отримали назву вандерваальсова сил. Вони включають в себе три складові: диполь-дипольна, індукційне і дисперсійне взаємодії.
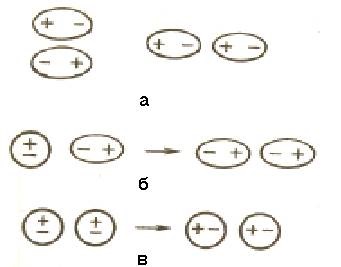
а - диполь-дипольна взаємодія; б - індукційне взаємодія;
в - дисперсійне взаємодія
Малюнок 6.1 - вандерваальсова взаємодії молекул
6.1.1 Диполь-дипольна взаємо-дія. При зближенні з-лярних молекул вони ориенти-ються таким чином, щоб позитивна сторона одного диполя була спрямована до негативного боку іншого диполя (рисунок 6.1, а).
Що виникає між диполя-ми взаємодія називається диполь-дипольним або орієнтаційний. Енергія диполь-дипольного взаємодії пропорційна електричному моменту диполя в четвертого ступеня і обернено пропорційна відстані між центрами диполів в шостого ступеня і абсолют-ної температурі в першого ступеня.
6.1.2 Индукционное взаємодія. Диполі можуть впливати на неполярні молекули, перетворюючи їх в індуковані (наві-денние) диполі (рисунок 6.1, б). Між постійними і наведеними ді-полями виникає тяжіння, енергія якого пропорційна електричному моменту диполя в другому ступені і обернено пропорційна відстані між центрами молекул в шостого ступеня. Енергія індукційного взаємодії зростає з увеличени третьому поляризуемости молекул, тобто здатності молекули до про-разованию диполя під впливом електричного поля. Величину поляризуемости висловлюють в одиницях об'єму. Поляризуемость в од-нотіпних молекулах зростає зі збільшенням розміру молекул (табліща 6.1). Енергія індукційного взаємодії значно менше енергії диполь-дипольного взаємодії.
6.1.3 Дисперсійне тяжіння. У будь-якій молекулі виникають флуктуації електричної щільності, в результаті чого з'являються миттєві диполі, які в свою чергу індукують миттєві диполі у сусідніх молекул (рисунок 6.1, в). Рух миттєвих диполів стає узгодженим, їх поява і розпад відбувається із-дит синхронно. В результаті взаємодії миттєвих диполів енергія системи знижується. Енергія дисперсионного взаємодій-наслідком пропорційна поляризуемости молекул і обернено пропорційна відстані між центрами частинок. Для неполярних молекул дисперсне взаємодія є єдиною складовою вандерваальсова сил (таблиця 6.1).
Таблиця 6.1 - Внесок окремих складових в енергію молекулярного взаємодії
Електричним ний момент диполя, D
Полярізу- емость, м 3 * 10 30
6.1.4 Енергія вандерваальсова взаємодії. Енергія всіх видів вандерваальсова взаємодії обернено пропорційна расстоя-нию між центрами молекул в шостого ступеня.
При сильному зближенні молекул виявляються сили відштовхуючись-ня між ними, які обернено пропорційні відстані між молекулами в дванадцятому ступені. Тому залежність ре-зультірующей енергії вандерваальсова взаємодії EB від рас-стояння між молекулами, IB. виражається рівнянням
де а і b - постійні.
Мінімальна енергія системи забезпечується при відстанях між центрами молекул 0,4 ÷ 0,5 нм, тобто істотно більше довжини хімічного зв'язку.
Як видно з таблиці 6.1, зі збільшенням розміру молекул в ряду Аг-Хе і НС1-HI зростає їх здатність до поляризації і енергія дисперсійних-ного тяжіння. Орієнтаційні взаємодія вносить значи-них внесок в вандерваальсови сили лише в разі молекул з великим електричним моментом диполя. Зі збільшенням сум-Марн енергії міжмолекулярної взаємодії зросте температура кипіння рідин, а також теплота їх випаровування. Сумарна енергія вандерваальсова взаємодії молекул на 1-2 порядки нижче енергії хімічних зв'язків.
Отже, між молекулами виникають відносно слабкі вандерваальсови взаємодії, що включають дисперсійні сили, а для полярних молекул і диполь-дипольна тяжіння і індукції-ційні взаємодії.