Як вже зазначалося вище, молекули складаються з атомів. Скільки ж є атомів різних видів, або, як їх називають, хімічних елементів.
В даний час відомі 102 елементу, які заповнюють клітини періодичної системи елементів Д. І. Менделєєва.
Всі різноманітні речовини, які ми бачимо в навколишньому світі, утворені в результаті з'єднання один з одним в різних комбінаціях цих хімічних елементів (атомів).
Для зручності написання хімічного складу різних речовин і їх хімічної взаємодії між собою в хімії прийняті умовні позначення кожного елемента, які утворені з початкових букв латинських назв цих елементів.
Латинська, який був спочатку розмовною мовою стародавнього Риму, а потім і всієї Римської імперії, згодом, після розпаду Римської імперії, в середні століття продовжував вживатися вченими, а в деяких науках він зберігся і до теперішнього часу.
Так, в медицині користуються латинською мовою для назв хвороб і ліків, в ботаніці - для назв рослин.
При знайомстві з питаннями обробки води найбільш часто зустрічаються такі одинадцять хімічних елементів:
За допомогою цих умовних позначень (символів) хімічних елементів можна зображувати молекули будь-яких речовин, а також різні хімічні процеси.
Цифра, що стоїть справа внизу символу, вказує кількість атомів в молекулі. Так, наприклад, хімічна реакція горіння палива в паровому котлі може бути позначена в такий спосіб:
вуглець кисень вуглекислий газ, і читається так: це плюс про два одно це про два.
Початкові припущення вчених про атом як про неподільної найменшої частинки матерії виявилися невірними. В даний час фізиками відкриті ще більш дрібні елементарні частинки, з яких побудовані всі атоми. Таких основних частинок є три: протони, нейтрони і електрони.
За дослідженнями останніх десятиліть, крім цих основних частинок відкрито ще багато різних дрібних часток (позитрон, фотон, нейтрино, мезони та ін.), Що виникають при радіоактивних розпадах і перетвореннях матерії.
Як же побудований атом з цих частинок? У центрі кожного атома знаходиться його ядро, що складається з протонів і нейтронів. Навколо ядра обертаються на різних відстанях від нього (орбітах) електрони, які є найлегшими з цих трьох видів частинок.
Вага електрона дорівнює 10 -27 м Протон і нейтрон мають майже однакову вагу, приблизно в 1850 разів важче електрона. Розміри протонів, нейтронів і електронів виражаються стотисячним частками ангстрема.
Розмір же зовнішньої орбіти обертаються електронів, що і є по суті розміром атома в цілому, коливається від 1 до 4 А. Отже, велика частина обсягу атома є порожньою, не заповнена матерією.
Але ми не бачимо не тільки атомів, але і молекул, і тому навколишні нас тіла здаються нам побудованими з суцільної матерії.
Основна маса атома зосереджена в ядрі. Якби ми могли наповнити 1 см 3 протонами і нейтронами так само щільно, як вони знаходяться в ядрах атомів, то вага такого кубика був би рівний приблизно вазі найвищої гори Кавказу Ельбрус. Таку щільність має матерія в надрах деяких зірок.
Протон і електрон мають протилежні, але рівні за величиною електричні заряди: у протона - позитивний заряд, у електрона - негативний. Нейтрони не мають електричного заряду.
Так як атом в цілому нейтральний, то кількість обертаються навколо його ядра електронів дорівнює кількості протонів в цьому ядрі. Таким чином, всі відомі нам різні хімічні елементи відрізняються один від одного кількістю що знаходяться в їх ядрах позитивно заряджених протонів і відповідно рівною кількістю обертаються навколо них на різних орбітах електронів.
На рис. 3 зображені спрощені схеми будови атомів деяких елементів.
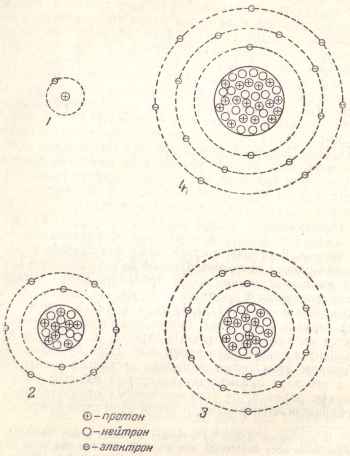
Мал. 3. Спрощені схеми будови деяких атомів: 1 - водень; 2 - кисень; 3 - натрій; 4 - хлор.
Атом водню має один електрон, і відповідно до цього в його ядрі знаходиться один протон. В ядрі атома кисню знаходяться вісім протонів, і оточують його вісім електронів, з яких два електрона обертаються по внутрішній першої орбіті, а шість електронів - по зовнішній другий орбіті.
У натрію, що має в ядрі 11 протонів і стільки ж електронів, останні розподілені по трьом орбітах: перша - два електрона (так само, як у атома кисню), друга - вісім електронів і третя, зовнішня, - один електрон.
У атома хлору з 17 протонами в ядрі є: два електрона в першій орбіті, вісім електронів на другий орбіті (стільки ж, скільки у кисню і натрію) і сім електронів на третій орбіті.
Встановлено, що на кожній орбіті може розміститися тільки певне граничне кількість електронів. Перша орбіта, безпосередньо оточує ядро, може вмістити тільки два електрона, друга - вісім, третя - вісімнадцять, четверта - тридцять два, п'ята - вісімнадцять і т. Д.
При цьому кожна наступна орбіта може мати електрон тільки за умови, що всі попередні орбіти максимально заповнені. Виявлено, що всі хімічні властивості елементів визначаються розташуванням його електронів і в першу чергу електронами, що знаходяться на зовнішній орбіті.
Ця залежність була геніально вгадати великим російським вченим Менделєєвим в його періодичної системі елементів, в якій порядковий номер положення елемента вказує число електронів в атомі. а в одному і тому ж стовпці таблиці знаходяться атоми з однаковим числом електронів в зовнішньому орбіті.
Оскільки основна маса атома зосереджена в ядрі, то і вага його приблизно визначається вагою ядра, що складається з протонів і нейтронів. Вага нейтронів незначно відрізняється від ваги протонів.
Кількість нейтронів в ядрі атома дорівнює числу протонів або трохи перевищує його. Таким чином, вага атома визначається загальним числом протонів і нейтронів в ядрі і називається тому масовим числом атома.
В даний час визначені абсолютні ваги різних атомів, вони виражаються надзвичайно малими величинами. Так, наприклад, якщо взяти навіть найважчий атом - урану, то його вага дорівнює всього 0,4Х10 -21 м
Звичайно, мати справу з такими величинами при розрахунках досить незручно. Тому в хімії прийнято спеціальну умовна міра ваги атомів, що дорівнює вазі найлегшого з них - атома водню, вага якого прийнято рівним 1,0 і тоді ваги всіх інших атомів показують, у скільки разів вони важче атома водню.
В даний час за одиницю атомної ваги приймається 1/16 атомної ваги кисню, що зручніше, так як при цьому атомні ваги багатьох елементів стають близькими цілим числам. Але тоді атомний вага самого водню виявляється рівним 1,008; для грубих підрахунків він може бути прирівняний 1,0.