Колоїдної системи в харчовому виробництві
Колоїдне стан характеризується наступними основними ознаками: певними розмірами частинок (10 -7. 10 -5 см), гетерогенність і многокомпонентностью.
Дисперсні системи з частинками колоїдних розмірів прийнято називати золями (від латинського слова solutio - розчин).
Системи з газовим дисперсійним середовищем незалежно від природи газу називають аерозолями. Системи з рідким дисперсійним середовищем - ліозолі (від грецького слова lios - рідина). Залежно від природи рідини ліозолі називають гидрозолей (вода), органозолі (органічне середовище) або більш конкретно - алкозолямі (спирти), етерозолямі (ефіри) і т. Д.
За розміром частинок золи займають проміжне положення між істинними розчинами і грубодисперсними системами - порошками, суспензиями і емульсіями. Колоїдні системи утворюються двома шляхами: диспергированием - дробленням
великих частинок грубодисперсних систем до колоїдної дисперсності; конденсацією - з'єднанням атомів іонів або молекул в більші частки колоїдних розмірів. При цьому необхідними умовами освіти колоїдних систем є нерозчинність речовини дисперсної фази в дисперсійному середовищі; досягнення частинками дисперсної фази колоїдної дисперсності; наявність стабілізатора, який повідомляє колоїдної системі агрегатівную стійкість.
Стабілізаторами можуть бути речовини, спеціально вводяться в дисперсійне середовище, наприклад поверхнево-активні речовини або продукти взаємодії дисперсної фази з дисперсійним середовищем. Стабілізатори створюють навколо колоїдних частинок адсорбційний захисний шар, що перешкоджає їх агрегатування.
У виробництві різних харчових продуктів диспергування і конденсація є одним із перших місць. Це обумовлено особливостями речовини в дисперсному стані, які забезпечують зручності фасування, транспортування, дозування, сприяють збільшенню швидкостей хімічних і біохімічних реакцій і процесів розчинення, сорбції, екстракції та інших процесів.
Диспергирование використовують при дробленні і подрібненні зерна в борошно, какао-бобів в какао терте і какао-порошок, цукру в цукрову пудру, в консервній промисловості при гомогенізації плодово-ягідних пюре і т. П.
Конденсація виникає в ректифікаційних апаратах при отриманні спирту, кристалізації цукру, випаровуванні розчинів, обклеювання вин і т. Д.
Колоїдні системи мають молекулярно-кінетичними властивостями, зумовленими мимовільним рухом частинок. Це такі властивості, як дифузія, осмотичний тиск і розподіл часток по висоті.
Причиною дифузії (мимовільне вирівнювання концентрацій) частинок в колоїдних системах є броунівський рух, яке, в свою чергу, є наслідком геплово-го руху молекул дисперсійного середовища. Швидкість дифузії обернено пропорційна розміру диффундирующих частинок, тому в колоїдних системах, частки яких мають розміри порядку 10_7. 10
5 см, т. Е. Значно більше молекул звичайних низькомолекулярних речовин, швидкість дифузії невелика.
На колоїдні частинки, розподілені в дисперсійному середовищі, діють дві протилежно спрямовані сили: сила тяжіння і сила дифузії. Під дією сили тяжіння частинки прагнуть осісти на дно - седіментіровать (від латинського слова sedimentum - осад). Сили дифузії ж прагнуть розподілити частки рівномірно по всьому об'єму системи. Таким чином, дисперсні системи здатні зберігати певний розподіл часток за обсягом. Ця здатність називається седіментіціонной або кінетичної стійкістю. Грубодисперсні системи кінетично нестійкі, їх частки великі і тому під дією сили тяжіння осідають на дно. Молекулярні системи (гази, розчини) мають дуже високу кінетичну стійкістю. Кінетична стійкість колоїдних систем залежить від розмірів їх часток: чим менше розмір часток, тим більше кінетично стійка колоїдна система.
Мікрогетерогенна СИСТЕМИ В харчових виробництв
До мікрогетерогенних системам з розміром частинок 10
5. 1СГ3 см відносять суспензії (Т / Ж), емульсії (Ж / Ж), піни (Г / Ж), аерозолі (Т / Г і Ж / Г) і порошки (Т / Р). Як правило, ці системи непрозорі, частки гетерогенних систем швидко осідають. Всі ці системи широко поширені в природі і мають велике значення в харчовій промисловості.
Суспензії. Являють собою дисперсні системи з твердою дисперсною фазою і рідким дисперсійним середовищем. До них відносяться фруктові та овочеві пасти, помадні цукеркові маси, какао терте і ін.
Суспензії мають ряд загальних властивостей з порошками; ці системи подібні до них по дисперсності. У харчовій промисловості суспензії утворюються при одержанні крохмалю, при осадженні опадів у виробництві цукру, пива, вина, в кондитерській промисловості і ін.
Емульсії. Дисперсні системи, що складаються з рідкої дисперсної фази і рідкого дисперсійного середовища, називаються емульсіями. Обов'язкова умова освіти емульсії - Нерозчинність речовини дисперсної фази в дисперсійному середовищі.
Зазвичай емульсії отримують методом механічного диспергування. Для цього використовують різні мішалки, змішувачі, гомогенізатори, колоїдні млини і ультразвук.
Рідини, з яких отримують емульсії, нерозчинні одна в одній і, отже, відрізняються за своїми властивостями.
Практично однією з рідин завжди є вода, а інший - будь-яка неполярная, нерозчинна у воді рідина, наприклад масло.
Емульсії - нестійкі системи. Нестійкість цієї системи проявляється в мимовільному злиття крапельок дисперсної фази - коалесценції, що призводить до руйнування емульсії і поділу її на два шари. Стійкість емульсій може надати тільки третій компонент - стабілізатор або емульгатор. Роль емульгатора в освіті стійкою емульсії полягає, по-перше, в тому, що він адсорбується на кордоні розділу фаз масло - вода (М / В) і знижує міжфазну поверхневий натяг, т. Е. Є поверхнево-активною речовиною, а по-друге , концентруючись на поверхні крапельок дисперсної фази, емульгатор утворює механічно міцний шар (плівку). Наявність такої захисної плівки на поверхні частинок дисперсної фази перешкоджають їх злиттю, т. Е. Охороняє емульсію від коалесценції.
Природа емульгатора визначає не тільки стійкість, але і тип емульсії. Емульгатори, розчинні у воді, сприяють утворенню прямих емульсій (М / В); емульгатори, розчинні в неполярних рідинах, дають зворотні емульсії (В / М).
Аерозолі та порошки. Це дисперсні системи, дисперсійним середовищем яких є газ (повітря), а дисперсною фазою можуть бути тверді частинки або крапельки рідини. Зазвичай аерозолі класифікуються за агрегатним станом дисперсної фази. Аерозоль з рідкої дисперсної фазою називають туманом, з твердою - димом і пилом. Аерозолі з твердою дисперсною фазою, розміри частинок якої більше, ніж у димів, називають зазвичай пилом. Цей поділ є досить умовним. Розміри частинок аерозолів лежать в межах від 10 -5 до 10 -2 см. Аерозолі мають велике практичне значення в ряді галузей харчової промисловості. До типових аерозолям відносяться водяний туман, топковий дим, борошняна і цукровий пил. У ряді випадків у промисловості вдаються до штучного отримання аерозолів. Так, для висушування соки, пюре, молоко розпилюють до дрібних крапельок в сухому гарячому повітрі. З утворюється аерозолю завдяки його великій питомій поверхні випаровування вологи йде дуже інтенсивно і сушка закінчується за 15. 20 с.
Освіта аерозолів може привести до небажаних і небезпечних наслідків. Так, пил багатьох речовин - борошна, цукру, крохмалю, вугілля - утворює з повітрям вибухонебезпечні суміші.
Порошок можна розглядати як обложені аерозолі з твердими частинками. Однак частинки в них можуть бути більшими і досягати в діаметрі 1. 2 мм. Розмір частинок промислових порошків визначається їх цільовим призначенням і часто є одним з основних показників якості продукту. Наприклад, дисперсність і розподіл часток за розмірами в какао-порошку впливають на смакові якості і харчову цінність цього продукту. Ступінь помелу зерна впливає на якість борошна.
Частинки порошку завжди знаходяться в контакті і з цієї причини мають властивість плинності, яке, в свою чергу, залежить від щільності, розміру і форми частинок, стану їх поверхні, вологості та інших властивостей. Підвищення дисперсності призводить до зменшення плинності внаслідок зростання загальної поверхні контакту. Збільшення вологості також знижує плинність порошків.
Піни. Висококонцентровані дисперсні с.істеми, в яких дисперсійне середовище - рідина, а дисперсна фаза - газ, називаються піною. Бульбашки газу в пенах мають великі розміри, форму багатогранників і відокремлені один від одного дуже тонкими шарами дисперсійного середовища. Для отримання пен застосовують діспергаціонние методи: інтенсивне струшування або перемішування рідини.
Стійку піну можна отримати тільки в присутності стабілізатора - піноутворювача. Це пов'язано з тим, що поверхня рідини, що стикається з газоподібної середовищем, знаходиться в особливих умовах у порівнянні з основною масою рідини. Ці умови виникають тому, що молекули поверхневого шару рідини на відміну від молекул, що знаходяться в глибині, піддаються неоднакового тяжінню молекул рідини і газу. Кожна молекула всередині рідини з усіх боків притягається сусідніми молекулами, розташованими на відстані радіуса сфери дії міжмолекулярних сил (рис. 36). В результаті сили тяжіння компенсуються і рівнодіюча цих сил дорівнює нулю.
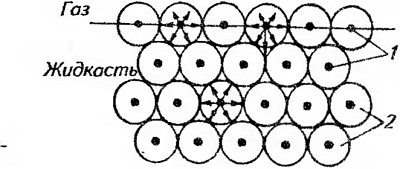
Мал. 36. Схема виникнення поверхневого натягу:
1 - молекули; 2 - сфери дії міжмолекулярних сил
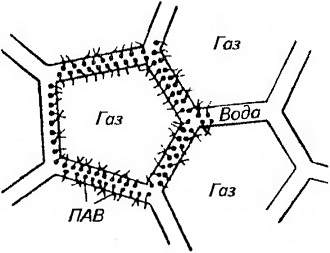
Мал. 37. Схема структури піни
У молекул поверхневого шару частина сфери дії міжмолекулярних сил знаходиться в газовій фазі, щільність якої менше щільності рідини, тому рівнодіюча всіх сил тяжіння буде спрямована всередину рідини перпендикулярно до її поверхні. Внаслідок цього поверхневі молекули рідини завжди перебувають під дією сили, яка прагне втягнути їх всередину. Це призводить до того, що поверхня рідини завжди прагне скоротитися. Цим пояснюються і куляста форма краплі рідини (куля має мінімальну поверхню), і ідеально гладка поверхня рідини в широкому посудині. При збільшенні поверхні певна кількість молекул з глибини жідкосгі переходить на поверхню. Процес перенесення молекул з рівноважного стану в особливий стан молекул поверхневого шару вимагає витрати зовнішньої роботи. Робота по збільшенню площі поверхні рідини переходить в потенційну енергію молекул поверхневого шару - поверхневу енергію. Остання, в свою чергу, віднесена до одиниці поверхні, називається поверхневий натяг
де F- поверхнева енергія; .V - площа поверхні.
Піноутворюючі речовини з довгим молекулярним ланцюгом зменшують поверхневий натяг, полегшують утворення піни і надають їй стабільність, так як вони адсорбуються на кордоні вода - повітря і утворюють високов'язку структуровану плівку, що перешкоджає сгеканію рідини (рис. 37). У цьому випадку товщина шару рідини між бульбашками повітря зменшується повільно і піна може існувати тривалий час.
Піноутворювачами можуть служити поверхнево-активні речовини (ПАР), молекули яких мають досить довгу вуглеводневий ланцюг. Багато молекули органічних речовин складаються з двох частин: полярної групи і неполярного вуглеводневого радикала. До полярних груп відносяться -СООН,
-ВІН, -NH, -SH, -CN і т. Д. Ці групи гідрофільних, т. Е. Добре змочуються водою. На відміну від них вуглеводневі радикали гідрофобні, т. Е. Не змочуються водою. Схематично дифільні, що складаються з гідрофільної і гідрофобних частин молекули зображують у вигляді символу - •, в якому прямою лінією позначають неполярний радикал, а гуртком - полярну групу.
До типових пенообразовате-иям водних пен відносяться спирти, мила, білки. Пенообразова-ііе має важливе практичне значення. Зокрема, багато продуктів, такі, як хліб і ряд кондитерських виробів, мають структуру піни, що визначає їх смакові властивості і харчову цінність.